Контрольные вопросы:
1. Сформулировать II начало термодинамики.
2. Что такое энтропия? Пояснить её физический смысл.
3. Записать основное тождество термодинамики и получить выражение для изменения энтропии при изотермическом и изохорическом процессах.
4. Что называется свободной энергией и как она связана с энтропией?
5. Сформулировать и объяснить закон возрастания энтропии.
6. Объяснить методику проведения измерений изменения энтропии в данной работе.
7. Каковы причины внесения погрешности в измеряемые величины?
Литература:
1. Фриш, С.Э. Курс общей физики: учебник: [в 3 т.]. Т. 1. Физические основы механики. Молекулярная физика. Колебания и волны / С.Э. Фриш. – 13-е изд., стер. – Санкт-Петербург [и др.]: Лань, 2009. – 480 с.: ил.
2. Савельев, И.В. Курс общей физики: учебное пособие для вузов [в 3 т.]. Т. 1. Механика. Молекулярная физика / И.В. Савельев. – 10-е изд., стер. – Санкт-Петербург [и др.]: Лань, 2008. – 432 с.: ил.
3. Трофимова, Т.И. Основы физики: учебное пособие: в 5 кн. Кн.2. Молекулярная физика. Термодинамика / Т.И. Трофимова. – Москва: Высшая школа, 2007. – 180 с.: ил.
4. Пронин, Б.В. Физика [Электронный ресурс]: учебник / Б.В. Пронин. – Москва: Издательство РГАУ-МСХА имени К.А. Тимирязева, 2012. – 445 с. – Режим доступа:
http://biblioclub.ru/index.php?page=book&id=144822
ЛАБОРАТОРНАЯ РАБОТА № 8
ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ТЕПЛОТЫ ПЛАВЛЕНИЯ
И ИЗМЕНЕНИЯ ЭНТРОПИИ ПРИ НАГРЕВАНИИ
И ПЛАВЛЕНИИ ОЛОВА
Цель работы: определение удельной теплоты и изменения энтропии при фазовом переходе первого рода на примере плавления и кристаллизации олова.
Краткая теория
Твердые тела разделяются на две группы, весьма существенно отличающиеся друг от друга по своим физическим свойствам: тела кристаллические и аморфные. В отличие от аморфных тел каждое кристаллическое тело при данном давлении имеет вполне определенную температуру плавления (кристаллизации). Если кристаллическое вещество, находящееся в твердом состоянии, нагревать, то при некоторой температуре начнется его плавление. В течение процесса плавления температура вещества будет оставаться неизменной. Эта температура называется температурой плавления. В обратном процессе – температурой кристаллизации. Температуры плавления и кристаллизации чистых веществ равны. При обычных колебаниях атмосферного давления температуру плавления кристаллических тел можно считать неизменной.
Процессы плавления и кристаллизации относятся к фазовым превращениям первого рода, сопровождающимся скачкообразным изменением плотности, внутренней энергии и энтропии. При этом поглощается (при плавлении) или выделяется (при кристаллизации) тепловая энергия, называемая скрытой теплотой фазового перехода или теплотой плавления (кристаллизации)
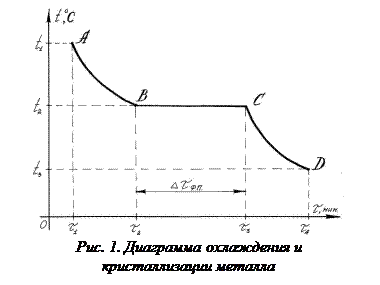
Одним из возможных способов измерения температуры и теплоты плавления (кристаллизации) является получение диаграммы плавления (кристаллизации), т.е. кривой зависимости температуры исследуемого кристаллического вещества от времени протекания процесса сообщения (отдачи) теплоты при неизменных внешних условиях. Для получения такой диаграммы тигель с исследуемым веществом помещается на нагревательный прибор. Нагревая (или охлаждая) вещество, производятся измерения его температуры через определенные интервалы времени. На рисунке 1 представлена диаграмма охлаждения и кристаллизации металла.
 В момент времени
В момент времени 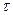 1 металл находится в жидком состоянии (точка А). Участок АВ соответствует охлаждению расплавленного металла. В момент времени
1 металл находится в жидком состоянии (точка А). Участок АВ соответствует охлаждению расплавленного металла. В момент времени 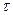 2 при температуре t2 начинается процесс кристаллизации (точка В), который заканчивается в момент времени
2 при температуре t2 начинается процесс кристаллизации (точка В), который заканчивается в момент времени 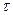 3. Интервал времени от
3. Интервал времени от 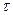 2 до
2 до 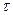 3 – время фазового перехода
3 – время фазового перехода 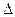
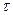 ф.п. (кристаллизации). t 2 – температура фазового перехода (температура кристаллизации металла). На участке СD происходит охлаждение твердого тела до температуры t3.
ф.п. (кристаллизации). t 2 – температура фазового перехода (температура кристаллизации металла). На участке СD происходит охлаждение твердого тела до температуры t3.
При достаточно медленном нагревании (охлаждении) можно считать, что температура одинакова во всех точках. Тепловая мощность (количество теплоты в единицу времени), подводимая к металлу (или отводимая при охлаждении), может быть рассчитана по формуле:
 (1)
(1)
где mM – масса исследуемого металла, mT – масса тигля, с M, с T – удельные теплоемкости исследуемого металла и тигля, соответственно.
При фазовом переходе тепловая мощность рассчитывается по формуле:
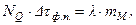 (2)
(2)
где 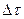 ф.п . – время фазового перехода,
ф.п . – время фазового перехода, 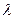 - удельная теплота плавления исследуемого металла. Исключив N Q из выражений (1) и (2), получим:
- удельная теплота плавления исследуемого металла. Исключив N Q из выражений (1) и (2), получим:
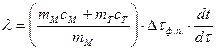 , (3)
, (3)
где 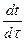 − скорость нагревания (охлаждения) исследуемого металла.
− скорость нагревания (охлаждения) исследуемого металла.
Рассчитав, таким образом, удельную теплоту фазового перехода 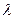 и по диаграмме плавления (кристаллизации) определив температуру фазового перехода Т
и по диаграмме плавления (кристаллизации) определив температуру фазового перехода Т 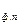 , можно рассчитать изменение энтропии данного фазового превращения.
, можно рассчитать изменение энтропии данного фазового превращения.
Функция состояния термодинамической системы, дифференциал которой dS при обратимом процессе равен отношению бесконечно малого количества теплоты 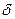 Q, сообщенного системе, к термодинамической температуре Т системы, называется энтропией, т.е.
Q, сообщенного системе, к термодинамической температуре Т системы, называется энтропией, т.е.
dS = 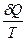 . (4)
. (4)
Энтропия всегда определяется с точностью до постоянной величины, поэтому смысл имеет лишь ее изменение при переходе системы из состояния 1 в состояние 2:
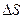 =
= 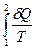 . (5)
. (5)
Процесс плавления (кристаллизации) металла протекает при постоянной температуре Т 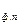 и, следовательно, является изотермическим. Изменение энтропии при таком процессе можно определить по формуле (5):
и, следовательно, является изотермическим. Изменение энтропии при таком процессе можно определить по формуле (5):
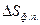 =
= 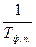
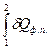 =
= 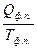 . (6)
. (6)
Изменение энтропии при нагревании и плавлении металла можно определить как сумму изменений энтропии при нагревании его от начальной температуры Т  до температуры плавления Т
до температуры плавления Т 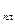 и при плавлении:
и при плавлении:
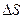 =
= 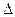 S
S 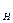 +
+  =
= 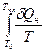 +
+  , (7)
, (7)
где 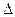 S
S 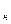 − изменение энтропии при нагревании,
− изменение энтропии при нагревании, 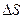
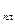 − изменение энтропии при плавлении. Учитывая, что
− изменение энтропии при плавлении. Учитывая, что 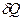 = c
= c 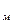 m
m 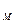 dT и, принимая во внимание Q
dT и, принимая во внимание Q 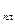 =
= 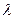 m
m 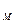 , получаем
, получаем
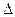 S = c
S = c 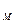 m
m 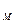
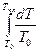 +
+  ,
,
или 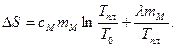 (8)
(8)
|
| Поделиться: |




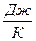
 Sсист.),
Sсист.), 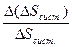 , %
, %



