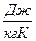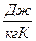Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Исследование изменения энтропииСодержание книги
Поиск на нашем сайте
В НЕОБРАТИМЫХ АДИАБАТНЫХ ПРОЦЕССАХ Цель работы: определение изменения энтропии изолированной системы тел при их тепловом необратимом адиабатном процессе взаимодействия.
Краткая теория Для описания поведения систем немецкий физик Рудольф Клаузиус ввел функцию параметров состояния, названную им энтропией. Пользуясь понятием энтропии, основное содержание II начала термодинамики можно сформулировать следующим образом: любой процесс в изолированной системе подчиняется условию:
где Более кратко II начало термодинамики можно сформулировать так: в процессах изолированной системы энтропия не убывает. В этом утверждении существенно, что оно относится к изолированным системам, в неизолированных системах энтропия может и возрастать, и убывать, и оставаться неизменной в зависимости от характера процесса. Отметим, что неизменной в неизолированной системе энтропия остается лишь при обратимых процессах, в необратимых же процессах она возрастает. Поскольку в предоставленной самой себе (изолированной) системе процессы идут, как правило, необратимо, это означает, что практически энтропия изолированной системы всегда растет. Рост энтропии означает приближение системы к состоянию термодинамического равновесия. Таким образом, первое начало термодинамики описывает количественные отношения между величинами, характеризующими систему, при различных изменениях в состоянии системы, но ничего не говорит о направлении этих изменений. Второе начало термодинамики указывает направление изменений в системе, если они должны произойти, или на отсутствие изменений, если они не могут произойти.
Теория метода В данной работе предлагается измерить изменение энтропии изолированной системы, в которой происходит необратимый процесс теплообмена. Вычисление основывается на том, что энтропия является функцией состояния. Если система перешла из одного состояния в другое посредством необратимого процесса, то логично мысленно перевести систему из первого состояния во второе с помощью некоторого обратимого процесса и рассчитать происходящее при этом изменение энтропии. Оно равно изменению энтропии при необратимом процессе. Рассмотрим изменение энтропии при выравнивании температуры двух тел, приведенных в тепловой контакт. Для упрощения расчета считаем, что теплообмен происходит при постоянном объеме каждого из тел, теплоемкости с1 и с2 не зависят от температуры, Т1>Т2. Для определения температуры Т3, которую будут иметь тела по достижении термодинамического равновесия, можно написать выражение: из которого следует, что Переход из состояния 1 в состояние 2 схематически представлен на рис.1.
где Вычислив интегралы, получим:
Данное выражение и показывает изменение энтропии в необратимом процессе. С помощью (2) прямой подстановкой в (4) убеждаемся, что Таким образом, энтропия при теплообмене увеличивается.
Экспериментальная установка
В предлагаемой установке в теплообмене участвуют четыре тела: 1.Испытуемый образец массой mT, удельной теплоемкостью сТ и начальной температурой ТТ (температура паров кипящей воды по шкале Кельвина, измеряемая термометром 4). 2.Стакан калориметра массой m к, удельной теплоемкостью ск и начальной температурой Т1. 3.Мешалка массой m 4.Вода, находящаяся в калориметре массой тВ,удельной теплоемкостью сВ и начальной температурой Т1 (измеряется термометром 5). После теплообмена устанавливается температура Т0. При этом энтропия каждого из тел изменится следующим образом: для 1 тела: для 2 тела: для 3 тела: для 4 тела: Учитывая свойство аддитивности энтропии, можно определить изменение энтропии всей системы:
Порядок выполнения работы
1. Определить массу (взвешиванием) и удельную теплоемкость (по справочнику) исследуемого тела (латунь, медь, алюминий, сталь), стакана калориметра (латунь), мешалки (латунь) и воды. Результаты измерений занести в таблицу 1. Таблица 1
2. Установить исследуемое тело в цилиндрическую полость водяного нагревателя, предварительно наполнив его водой до определенного уровня (примерно на 2см ниже верхнего края) и включить электроплитку. 3. Через 10-15 минут после закипания воды в нагревателе, измерить температуру ТТ и вытолкнуть исследуемое тело в калориметр, предварительно измерив температуру воды в калориметре Т1. Быстро закрыв калориметр, отставить его подальше от нагревателя и следить за повышением температуры в калориметре. Когда рост температуры замедлится, сделать 3-5 перемешиваний мешалкой. Установившееся значение температуры Т0 в калориметре занести в таблицу 2. 4. По измеренным данным, пользуясь формулами (5), рассчитать изменение энтропии каждого из тел, участвующих в теплообмене. По формуле (6) найти изменение энтропии системы. Результаты занести в таблицу 2. 5. Не выливая воду из калориметра, повторить измерения с другими исследуемыми телами (по указанию преподавателя), предварительно извлечь из калориметра предыдущий исследуемый образец. 6. Рассчитать абсолютную и относительную погрешности измерений, результаты занести в таблицу 2. Таблица 2
| ||||||||||||||||||||||||||||||
|
| Поделиться: |
Последнее изменение этой страницы: 2021-04-05; просмотров: 158; Нарушение авторского права страницы; Мы поможем в написании вашей работы!
infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.105.184 (0.01 с.)

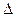 S
S 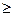 0, (1)
0, (1)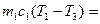
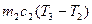 , (1)
, (1)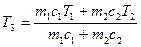 . (2)
. (2)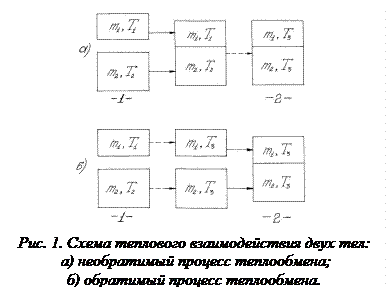 Рассмотрим необратимый процесс теплообмена при контакте двух тел. В исходном состоянии тела массами
Рассмотрим необратимый процесс теплообмена при контакте двух тел. В исходном состоянии тела массами 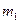 и
и 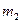 изолированы друг от друга и имеют разную температуру. Затем они приводятся в тепловой контакт. В результате теплообмена они приходят в состояние 2. Однако переход из состояния 1 в состояние 2 можно совершить так же и с помощью обратимых процессов. В этом случае тела считаются изолированными (рис. 1б) и каждое из них обратимым процессом приводится в состояние 2 при одинаковой температуре Т3. После этого они приводятся в контакт, но это никакого изменения в их состояние не вносит. Таким образом, в обоих случаях начальное и конечное состояния одинаковы и изменение энтропии можно рассчитать с помощью обратимого процесса по формуле:
изолированы друг от друга и имеют разную температуру. Затем они приводятся в тепловой контакт. В результате теплообмена они приходят в состояние 2. Однако переход из состояния 1 в состояние 2 можно совершить так же и с помощью обратимых процессов. В этом случае тела считаются изолированными (рис. 1б) и каждое из них обратимым процессом приводится в состояние 2 при одинаковой температуре Т3. После этого они приводятся в контакт, но это никакого изменения в их состояние не вносит. Таким образом, в обоих случаях начальное и конечное состояния одинаковы и изменение энтропии можно рассчитать с помощью обратимого процесса по формуле: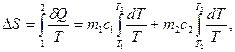 (3)
(3)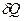 = mcdT.
= mcdT.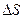 = m 1 c 1 ln
= m 1 c 1 ln 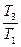 + m 2 c 2 ln
+ m 2 c 2 ln 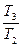 . (4)
. (4)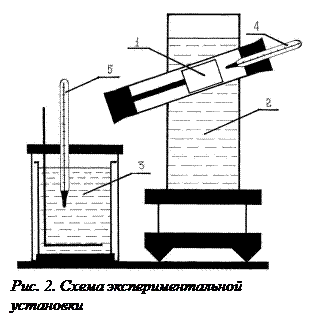 Схема экспериментальной установки представлена на рис. 2. Теплообмен происходит при опускании исследуемого тела 1, нагретого в водяном нагревателе 2 до температуры ТТ в воду, находящуюся в калориметре 3 при температуре Т1 . Наличие внешнего стакана калориметра делает систему практически изолированной.
Схема экспериментальной установки представлена на рис. 2. Теплообмен происходит при опускании исследуемого тела 1, нагретого в водяном нагревателе 2 до температуры ТТ в воду, находящуюся в калориметре 3 при температуре Т1 . Наличие внешнего стакана калориметра делает систему практически изолированной.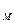 , удельной теплоемкостью с
, удельной теплоемкостью с 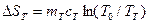 ;
;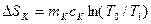 ;
;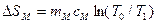 ; (5)
; (5)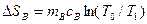 .
.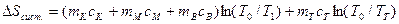 (6)
(6) ,
,