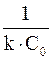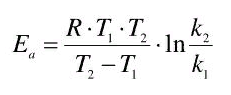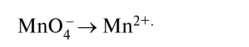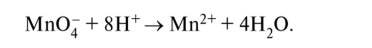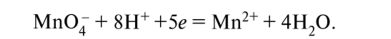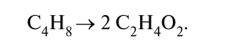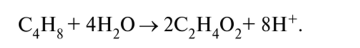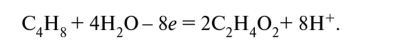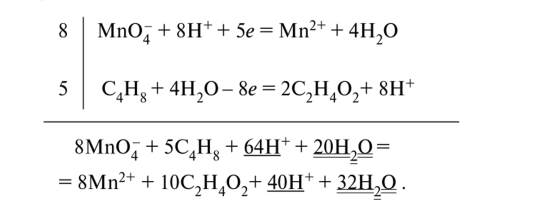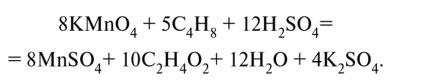Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая термодинамика. Открытая, закрытая, изолированная системы.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Химическая термодинамика. Открытая, закрытая, изолированная системы. Химическая термодинамика – раздел физической химии, где изучаются взаимные превращения различных форм энергий в ходе химических реакций, а также определяется принципиальная возможность, направление и предел самопроизвольного протекания процессов в заданных условиях. Термохимия – раздел химической термодинамики, в котором объектом изучения являются тепловые эффекты процессов, теплоёмкости веществ и другие, связанные с ними величины. Основная задача термохимии заключается в прямом или косвенном определении (путём измерений или вычислений) тепловых эффектов химических реакций и различных физико-химических процессов (например, фазовых, агрегатных превращений). Другой важной задачей термохимии является изучение теплоёмкости веществ. Экспериментальным методом термохимии служит калориметрия. Термохимические данные и выявленные закономерности используются для расчётов тепловых балансов химико-технологических процессов и выбора (сочетании с другими термодинамическими характеристиками) оптимальных условий их проведения. Термохимические исследования позволяют связать энергетические характеристики веществ с их составом, строением и реакционной способностью. Термодинамическая система – совокупность тел (веществ), находящихся во взаимодействии и отделённых от окружающей среды условной (воображаемой) или реальной границей (поверхностью раздела). В химической термодинамике рассматриваются только макроскопические системы, состоящие из очень большого числа частиц - поскольку только к этим системам применимы такие понятия как: температура, давление, теплота и некоторые другие. Взаимодействие системы с окружающей средой может происходить путём обмена энергией (механической, тепловой и др.) и веществом. Открытая система – система, которая обменивается с окружающей средой и веществом, и энергией. Закрытая система – система, которая обменивается с окружающей средой только энергией. В такой системе отсутствует обмен веществом с окружающей средой. Изолированная система – система, которая не обменивается с окружающей средой ни веществом, ни энергией. Экстенсивные и интенсивные свойства. Функции состояния и функции процесса.
Экстенсивное свойство – свойство, которое зависит от количества вещества. Например, масса, объём, теплоёмкость, энтропия и т.д. Интенсивное свойство – свойство, которое не зависит от количества вещества. Например, плотность, удельная теплоёмкость и т.п. • Состояние системы – совокупность физических и химических свойств, характеризующих эту систему. Состояние термодинамической системы определяется термодинамическими параметрами (температура, давление, объем, концентрация и пр.). Функции состояния – термодинамические свойства системы, изменение которых при переходе из одного состояния системы в другое зависит только от её начального и конечного состояния и не зависит от пути (способа) перехода. Функции процесса – термодинамические свойства системы, изменение которых при переходе из одного состояния системы в другое зависит от пути (способа) перехода. I начало термодинамики. Теплота процесса при изохорном и изобарном процессе. Первое начало термодинамики
Первое начало термодинамики представляет собой одну из формулировок закона сохранения энергии. Для бесконечно малого процесса его можно представить в виде
где Q – теплота процесса; U – внутренняя энергия системы; W – работа, совершаемая системой или над системой в термодинамическом процессе. Понятия теплоты и работы применимы только к процессам, но не к состоянию системы. Теплота и работа являются функциями процесса, их изменение зависит от пути протекания процесса. Поэтому бесконечно малые величины теплоты и работы не обладают свойствами дифференциала и для их обозначения используют греческую букву δ. Внутренняя энергия, напротив, является функцией состояния, поэтому для обозначения её бесконечно малого изменения используется знак дифференциала d. Для конечного процесса первое начало термодинамики записывают:
Согласно первому началу термодинамики, теплота, подведённая к закрытой системе, расходуется на увеличение её внутренней энергии и совершение работы. В термодинамике используют следующую систему знаков. Положительной считают теплоту, подведённую к системе, а отрицательной – отведённую от неё. Работу, совершенную системой, считают положительной, а совершаемую над системой, например, работу сжатия – отрицательной.
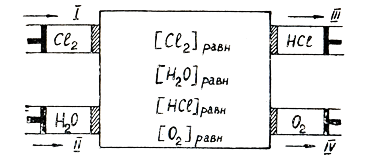
Химическая реакция 2Сl2(г) + 2H2O(г) = 4HCl (г) +O2(г)
Ящик Вант-Гоффа P,T=const
Реальные процессы (расширение газа, передача тепла, хим. реакция) определенных условиях можно провести термодинамически обратимо. II начало термодинамики: · Томпсон: Невозможна периодически действующая машина, единственным результатом которой было бы получение работы за счёт охлаждения теплового резервуара. · Оствальд: Невозможно создание вечного двигателя 2-го рода.
Анализ уравнения изобары • Рассмотрим случай, когда реакция проводится при p=1 атм. Тогда уравнение (∂lnKp/∂T)p = ∆H/RT2 примет следующий вид: • dlnKp/dT = ∆H0/RT2 • 1) ∆H0 > 0, следовательно, ∆H0/RT2 > 0, то есть, при увеличении температуры (dT > 0) величина lnKp, а следовательно, и Kp возрастает, а при уменьшении температуры Kp уменьшается. • 2) ∆H0 < 0, следовательно, dlnKp/dT < 0, то есть, с ростом аргумента Т величина lnKp, а, значит, и Kp уменьшается. • 3) ∆H0 = 0; dlnKp/dT = 0. Функция lnKp, а также и Kp, не зависит от температуры, то есть, Kp =const при Т ≠const. • Проведённый анализ является частным случаем применения принципа Ле-Шателье, когда внешним, воздействующим на систему, фактором является температура (то есть, как влияет изменение температуры на смещение равновесия в случае эндо- и экзотермических реакций). • В интегральной форме уравнение изобары химической реакции имеет следующий вид: • ln(K2/K1) = (∆H0/R) ∙ (1/T1 – 1/T2) • Таким образом, зная значения константы равновесия K1 и K2 при двух температурах Т1 и Т2, можно рассчитать величину теплового эффекта реакции ∆H0 или же, зная величину ∆H0 и значение константы равновесия при какой-либо температуре Т1, можно определить и константу равновесия при другой температуре Т2. Химическая кинетика Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики. Скорость химической реакции Дадим определение основному понятию химической кинетики – скорости химической реакции: Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объёма (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций). Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени. Первое определение является наиболее строгим; из него следует, что скорость химической реакции можно также выражать как изменение во времени любого параметра состояния системы, зависящего от числа частиц какого-либо реагирующего вещества, отнесённое к единице объёма или поверхности – электропроводности, оптической плотности, диэлектрической проницаемости и т.д. и т.п. Однако наиболее часто в химии рассматривается зависимость концентрации реагентов от времени. В случае односторонних (необратимых) химических реакций (здесь и далее рассматриваются только односторонние реакции) очевидно, что концентрации исходных веществ во времени постоянно уменьшаются (ΔСисх < 0), а концентрации продуктов реакции увеличиваются (ΔСпрод > 0). Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рисунок 2.1).
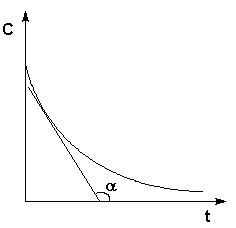
Рис. 2.1 Кинетические кривые для исходных веществ (А) и продуктов реакции (В). Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
Рис. 2.2 Графическое определение Vист.
Необходимо отметить, что в том случае, если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение концентрации какого реагента определялось. Очевидно, что в реакции 2Н2 + О2 → 2Н2О концентрации водорода, кислорода и воды изменяются в различной степени: ΔС(Н2) = ΔС(Н2О) = 2 ΔС(О2). Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и т.д. Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики: Правило Вант-Гоффа При повышении температуры на каждые 10∘С скорость большинства химических реакций увеличивается в 2–4 раза.
Для гетерогенных реакций (то есть реакций, протекающих с участием веществ в двух или более разных агрегатных состояниях) уравнение скорости реакции учитывает площадь соприкосновения частиц:
где S — площадь соприкосновения частиц, мм2, Δn — изменение количества веществ, вступивших или образовавшихся в ходе реакции, моль;
Δt — промежуток времени, с; Vгетер. — скорость гетерогенной реакции, мольмсмольм2⋅с. Соответственно, для увеличения скорости реакции нужно увеличить площадь соприкосновения веществ. Сделать это можно следующим образом: · твёрдые вещества — измельчить (до гранул, стружки, порошка, мелкодисперсного порошка); · жидкости — распылить. Площадь соприкосновения реагентов зависит и от их агрегатного состояния: жидкости реагируют друг с другом с максимальной скоростью, твёрдое вещество с жидкостью реагирует медленнее, и наконец минимальная скорость взаимодействия наблюдается для взаимодействия двух твёрдых веществ.
Влияние катализатора Определение Катализатор — вещество, изменяющее скорость химической реакции и не расходующееся в процессе взаимодействия. Катализатор претерпевает изменения в ходе реакции (стадии каталитического цикла), но к концу цикла остаётся неизменным. Катализ — отдельный раздел химии, которому посвящено очень много работ. Без каталитических процессов невозможно представить себе сегодняшнюю химическую промышленность. Существуют целые семейства катализаторов, например катализаторы гидрирования или катализаторы окисления. Подобрать катализатор для определенной реакции, отвечающий целому ряду требований (экологичности, экономичности, безопасности и др.), — сложная, трудоёмкая задача. Наряду с катализаторами существуют вещества, наоборот, замедляющие химическое взаимодействие - ингибиторы. Ингибиторы — вещества, замедляющие химическую реакцию. Реакции второго порядка. К реакциям второго порядка относятся реакции соединения типа A + B→C, реакции обмена A + B = C + D, а также реакции разложения и др. Скорость реакции второго порядка определяется уравнением
где k — константа скорости реакции; а — число молей вещества А в начале реакции; b — число молей вещества В в начале реакции; х —число прореагировавших молей. Здесь возможны два случая. Первый случай — это когда какое-то количество вещества А вступает в реакцию с эквивалентным количеством вещества В, т. е. когда а = b. И второй случай более сложный — это когда а ≠ b. Рассмотрим оба эти случая. Первый случай (а= b). Поскольку исходные концентрации реагирующих веществ равны между собой, уравнение (2.13) примет вид
Разделяя переменные и производя интегрирование, получим
При t = 0 x = 0, откуда const =1/а. После подстановки этой величины в уравнение (2.15) получим
Размерность константы скорости реакции второго порядка t -1 C -1. Поэтому в отличие от константы скорости первого порядка численное значение k зависит от того, в каких единицах выражены t и С. Если последняя выражена в кмоль/м3, а время в с, то k имеет размерность [с-1·(кмоль/м3)-1]. Для реакций второго порядка большую роль играет число столкновений, которые происходят в единицу времени между молекулами реагирующих веществ. Число столкновений, в свою очередь, пропорционально числу молекул в единице объема, т. е. концентрации. Таким образом, константа скорости, а следовательно, и скорость реакции второго порядка зависят от разбавления раствора.
Второй случай (а ≠ b). Если для реакции взяты неэквивалентные количества реагирующих веществ, скорость реакции выразится так:
После разделения переменных получим это уравнение в другом виде:
Выражение, стоящее в левой части уравнения (2.18), можно представить как
После подстановки этого выражения в уравнение (2.13) получим
После интегрирования
Поскольку при t = 0 х = 0, постоянная интегрирования
Подставляя это выражение в уравнение (2.16), найдём
Это и есть кинетическое уравнение реакции второго порядка. Примером подобной реакции может служить омыление эфиров щелочами: СН3COOC2Н5 + ОН- →СН3COO- + C2Н5ОН Кинетика реакций второго порядка была детально изучена С. Г. Крапивиным ещё в 1915 г. Реакции третьего порядка встречаются очень редко и потому не имеет смысла рассматривать математический вывод их кинетического уравнения. Существуют экспериментальные способы определения порядка реакции, основные из них: избыточных концентраций, подстановки в кинетическое уравнение реакций, определение полупериода реакций, графический. Вид уравнения зависимости концентрации от времени для реакций второго порядка рассмотрим только для простейшего случая, когда в элементарном акте участвуют 2 одинаковые молекулы, или молекулы разных веществ, но начальные концентрации их (С0) равны. При этом линейная зависимость наблюдается в координатах 1/С, t (рис. 40). Математическое уравнение этой зависимости запишется следующим образом
k = и измеряется в л?с -1?моль -1, т.е. ее численное значение зависит от того, в каких единицах измеряется концентрация вещества. Период полупревращения реакций второго порядка обратно пропорционален начальной концентрации реагента t½= Это связано с тем, что скорость реакций второго порядка в сильной мере зависит от числа столкновений между молекулами реагирующих веществ в единицу времени, которое, в свою очередь, пропорционально числу молекул в единице объёма, т. е. концентрации вещества. Таким образом, чем больше концентрация вещества в системе, тем чаще сталкиваются молекулы между собой и тем за меньший промежуток времени половина их успеет прореагировать. Уравнение Аррениуса
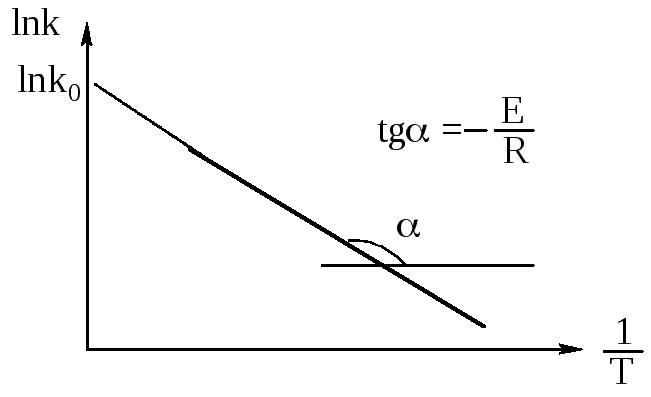
Энергия активации
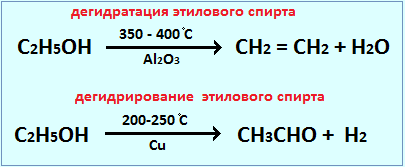
Катализ и катализаторы Катализ – это процесс изменения скорости химической реакции при помощи катализаторов – веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся. Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами. Различают гомогенный и гетерогенный катализ. Гомогенный катализ. При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO 2 и SO 3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами). Гетерогенный катализ. В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN 3 до NO в присутствии Pt (катализатор – твердое вещество). Применение катализаторов Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO 3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование: Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами. Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ. Степень окисления. Валентность. Расчёт степени окисления. Примеры. Валентность – Ø это число химических связей, которое данный атом образует с другими атомами. Ø Электроны, принимающие участие в образовании химических связей, называют валентными Ø Валентные электроны располагаются на внешнем уровне (для главных подгрупп) и предвнешнем d-подуровне (для побочных подгрупп) Валентность определяется: Числом пустых орбиталей Степень окисления • Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (ионные и ковалентно-полярные) состоят только из ионов. • Степень окисления – условный заряд, который образуется в результате отдачи или принятия электронов Примеры • Степень окисления кислорода всегда равна «-2» Исключение: +1 -1 пероксиды H 2 O 2 + +2 -1 фторид кислорода OF 2 • Cтепень окисления водорода всегда равна «+1» Исключение: гидриды металлов
• Металлы в соединениях всегда имеют положительное значение степени окисления • Степени окисления металлов главных подгрупп численно равна номеру группы
• В соединениях сумма значений положительных и отрицательных степеней окисления равна нулю +3 -2 Al2O 3 (+3)*2 + (-2)*3 = (+6) +(-6) = 0 • Степень окисления атомов в простых веществах равна нулю
Примеры степеней окисления
Химические реакции без и с изменением степени окисления. Примеры. Существует два типа химических реакций: A Реакции, в которых не изменяется степень окисления элементов: Реакции присоединения SO2 + Na2O = Na2SO3 Реакции разложения Cu(OH)2 = CuO + H2O Реакции обмена AgNO3 + KCl = AgCl + KNO3 NaOH + HNO3 = NaNO3 + H2O B Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений и передача электронов от одних соединений к другим: 2Mg0 + O20 = 2Mg+2O-2 2KI-1 + Cl20 = 2KCl-1 + I20 Mn+4O2 + 4HCl-1 = Mn+2Cl2 + Cl20 + 2H2O Такие реакции называются окислительно - восстановительными. Типичные восстановители Простые вещества • H2 • Щелочные металлы • Щелочноземельные металлы • C • Zn • AI Сложные вещества • KI • NH3 • H2S • CO • Na2SO3 • NaNO2 Типичные окислители Простые вещества • F2 • CI2 • O2 Сложные вещества • KCIO3 • H2SO4 • HNO3 • KMnO4 • MnO2 • K2Cr2O4 Классификация окислительно-восстановительных реакций. Примеры Окислительно-восстановительные реакции делятся на три вида: · межмолекулярные ОВР - окислителем и восстановителем являются два разных вещества (простые или сложные); · внутримолекулярные ОВР - окислитель и восстановитель находятся в одной молекуле; · реакции диспропорционирования (дисмутации, самоокисления-самовосстановления) - в одном и том же веществе имеется элемент с промежуточной степенью окисления, который в ходе реакции, одновременно, и окисляется, и восстанавливается. Межмолекулярные ОВР Примеры межмолекулярных окислительно-восстановительных реакций между газообразными веществами: H20+Cl20 = 2H+1Cl-1 3H20+N20 = 2N-3H3+1 2N+2O+O20 = 2N+4O2-2 4N-3H3+3O20 = 2N20+6H2O-2 Примеры межмолекулярных ОВР между твёрдыми веществами и газообразными (окисление металлов): 2Mg0+O20 = 2Mg+2O-2 2Sb0+3Cl20 = 2Sb+3Cl3-1 Примеры межмолекулярных ОВР между твёрдыми веществами и растворами: Mn+4O2+4HCl-1 = Cl20+Mn+2Cl2+2H2O 2KMn+7O4+16HCl-1 = 5Cl20+2Mn+2Cl2+2KCl+8H2O Примеры межмолекулярных ОВР между твёрдыми веществами: 2Al0+Fe2+3O3 = Al2+3O3+2Fe0 Примеры межмолекулярных ОВР, протекающих в растворах: 3Na2S+4O3+K2Cr2+6O7+4H2SO4 = 3Na2S+6O4+Cr2+3(SO4)3+K2SO4+4H2O Ионное уравнение: 3SO32-+Cr2O72-+8H+ = 3SO42-+2Cr3++4H2O Реакции коммутации: 2H2S-2+H2S+4O3 = 3S0+3H2O 5HCl-1+HCl+5O3 = 3Cl20+3H2O Внутримолекулярные ОВР Внутримолекулярные окислительно-восстановительные реакции являются реакциями разложения: N-3H4N+3O2 = N20+2H2O N-3H4N+5O2 = N2+1+2H2O 2NaN+5O3-2 = 2NaN+3O2+O20 2KCl+5O3-2 = 2KCl-1+3O20 Реакции диспропорционирования Cl20+H2O ↔ HCl+1O+HCl-1 4KCl+5O3 = 3KCl+7O4+KCl-1 3NaCl+1O = NaCl+5O3+2NaCl-1 4Na2S+4O3 = 3Na2S+6O4+Na2S-2 3HN+3O2 = HN+5O3+2N+2O+H2O Реакции диспропорционирования могут протекать только в присутствии веществ, которые имеют элементы с промежуточной степенью окисления. Например, марганец в манганате калия K2Mn+6O4 имеет промежуточную степень окисления +6. Поскольку, ион MnO42- имеет изумрудный цвет, то и раствор манганата калия имеет зелёный цвет. Реагируя с водой, манганат калия образует перманганат калия KMnO4, а цвет раствора становится буро-красным, в результате выпадения в осадок оксида магния MnO2. 3K2Mn+6O4+2H2O = 2KMn+7O4+Mn+4O2+4KOH 2Mn+6-2e- = 2Mn+7 (окисление) Mn+6+2e- = Mn+4 (восстановление) Как видно из уравнения реакции, в двух из трёх ионов MnO42-, присутствующих в молекуле манганата калия, атомы марганца отдают по одному электрону, выступая в роли восстановителя, а в третьем ионе атом марганца принимает эти два электрона от своих "братьев", играя роль окислителя. Таким образом, молекула манганата калия в ходе реакции проявляет, как восстановительные, так и окислительные свойства. Метод электронного баланса. Примеры Zn + HNO3 → Zn(NO3)2 + NO + H2O Zn0-2e=Zn2+ ½3 восстановитель N+5+3e=N+2 ½2 окислитель 3Zn + 4HNO3 = Zn(NO3)2 + 2NO + 2H2O Сначала расставляются коэффициенты в веществах, полностью изменяющих степень окисления. Затем по балансу элементов расставляют коэффициенты у всех остальных веществ HCI + MnO2 → CI2 + MnCI2 + H2O 2Cl-1 -2e=Cl20 ½1 восстановитель Mn+4+2e=Mn+2 ½1 окислитель 4HCI + MnO2 = CI2 + MnCI2 + H2O
KMnO4 + HCI → KCI + MnCI2 + CI2 + H2O Mn+7 +5e=Mn+2 ½2 окислитель 2Cl-1-2e=Cl20 ½5 восстановитель 2KMnO4 + 16HCI → 2KCI + 2MnCI2 + 5CI2 + 8H2O Метод электронно-ионного баланса. Примеры 1) в молекулярной схеме реакции находим степени окисления атомов тех элементов, которые её изменяют. Напишем ионно-молекулярную схему реакции, включающую окислитель, восстановитель, продукты их реакции и, если известно, среду; 2) составляем ионно-электронные уравнения отдельно для процессов окисления и восстановления: сначала уравняем частицы в левой и правой частях уравнения, используя для этого молекулы Н20 и, в зависимости от среды, ионы Н+ или ОН-, а затем уравняем заряд добавлением (или вычитанием) электронов в левую часть (из левой части) уравнения; 3) находим наименьшее общее кратное для электронов окислителя и восстановителя, и соответствующие множители; 4) суммируем полуреакции окисления и восстановления с учётом множителей, получаем ионно-молекулярное уравнение, а затем пишем молекулярное уравнение реакции. Пример 1. Бутен-2, СН3-СН=СН-СН3, или С4Н8, окисляется перманганатом калия КМп04 в сернокислой кислой среде до уксусной кислоты СН3СООН, или С2Н402:
Запишем ионно-молекулярную схему:
Схема полуреакции восстановления:
Уравняем кислород, учитывая, что в кислой среде присутствуют ионы водорода Н+ и молекулы воды; присутствие гидроксид-ионов ОН~ исключено. Один несбалансированный атом кислорода связывается в воду двумя ионами Н+. Поэтому в левую часть полуреакции на четыре избыточных атома кислорода добавляем восемь ионов водорода Н+, при этом в правой части образуется четыре молекулы воды:
Недостаток заряда в левой части обозначим через х и определим его по балансу заряда: -1 + 8 + х = +2, отсюда х = -5. Поскольку электрон имеет единичный элементарный отрицательный заряд, это соответствует принятию пяти электронов:
Проверим по заряду: -1 + 8 + 5 • (-1) = +2. Схема полуреакции окисления (левую часть удваиваем для баланса по углероду и водороду):
Свяжем четыре избыточных атома кислорода справа, добавив в правую часть уравнения восемь ионов водорода Н+; в левой части появится четыре молекулы воды:
Недостаток заряда в левой части х = + 8; что соответствует отдаче восьми электронов:
Наименьшее общее кратное числа принятых (5) и отданных (8) электронов равно 40. Суммируем полуреакции восстановления и окисления с учётом множителей:
Подчёркнутые члены уравнения являются подобными, поэтому они сокращаются. После сокращения получим ионно-молекулярное уравнение реакции:
Проверим баланс по заряду: 8 • (-1) + 24 = 16; 8 • 2 = 16. Составим молекулярное уравнение:
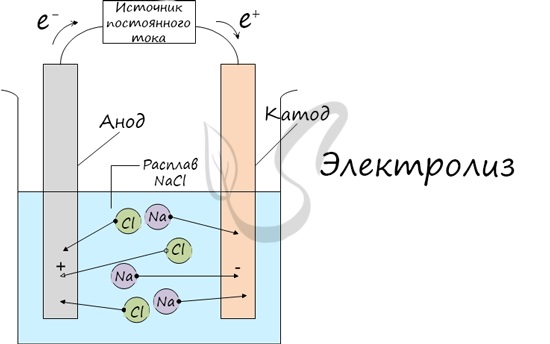
уравняв в нем дополнительно ионы К+ и SO^-, не принимавшие участия в процессах окисления и восстановления. Проверим баланс по кислороду: 8-4 + 12-4 = 80; 8-4 + 10-2 + + 12 + 4-4 = 80. Электролиз Электролиз (греч. elektron - янтарь + lysis — разложение) - химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока. Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
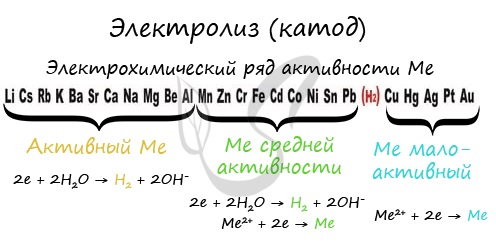
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья. Катод К катоду притягиваются катионы - положительно заряженные ионы: Na+, K+, Cu2+, Fe3+, Ag+ и т.д. Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) - на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag). Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды - выделяется водород. В случае, если на катод поступают ионы водорода - H+ (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H+ - 2e = H2 Анод К аноду притягиваются анионы - отрицательно заряженные ионы: SO42-, PO43-, Cl-, Br-, I-, F-, S2-, CH3COO-.
При электролизе кислородсодержащих анионов: SO42-, PO43- - на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород. Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор - если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор - самый электроотрицательный элемент, поэтому и является исключением. Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ - CO2. Примеры решения В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности м
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 599; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.148.222 (0.012 с.) |

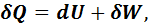
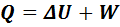
 (II.1)
(II.1) (II.2)
(II.2)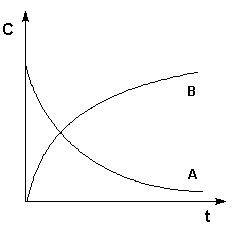
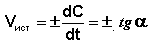 (II.3)
(II.3) ,
,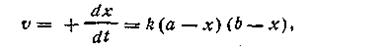
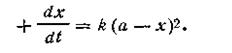
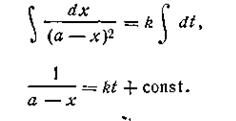
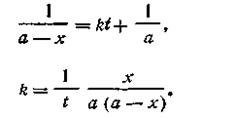
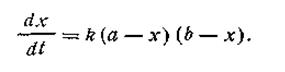
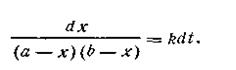
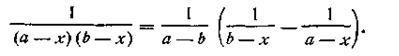
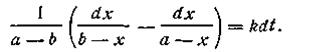
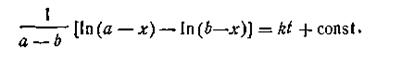
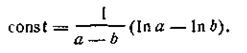
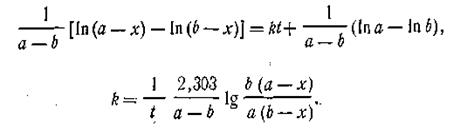
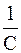 =
= 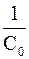 + kt
+ kt
 (
(