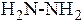Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
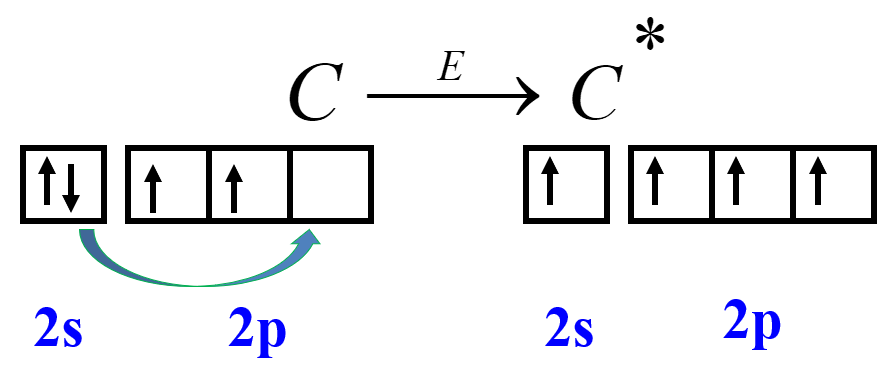
Числом неспаренных электронов атома
определяем по № группы для главных подгрупп (В возбуждённом состоянии электроны могут распариваться)
Числом пустых орбиталей Наличием неподелённых электронных пар
Степень окисления • Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (ионные и ковалентно-полярные) состоят только из ионов. • Степень окисления – условный заряд, который образуется в результате отдачи или принятия электронов Нахождение степени окисления Значение степени окисления определяется числом электронов, смещённых от данного атома к атому более электроотрицательного элемента: • Степень окисления имеет знак «+», если электроны отданы Na0 -1e = Na+1 • и знак «-», если электроны приняты Cl0 +1e = Cl-1 Примеры • Степень окисления кислорода всегда равна «-2» Исключение: +1 -1 пероксиды H 2 O 2 + +2 -1 фторид кислорода OF 2 • Cтепень окисления водорода всегда равна «+1» Исключение: гидриды металлов
• Металлы в соединениях всегда имеют положительное значение степени окисления • Степени окисления металлов главных подгрупп численно равна номеру группы
• В соединениях сумма значений положительных и отрицательных степеней окисления равна нулю +3 -2 Al2O 3 (+3)*2 + (-2)*3 = (+6) +(-6) = 0 • Степень окисления атомов в простых веществах равна нулю
Примеры степеней окисления
Химические реакции без и с изменением степени окисления. Примеры. Существует два типа химических реакций: A Реакции, в которых не изменяется степень окисления элементов: Реакции присоединения SO2 + Na2O = Na2SO3 Реакции разложения Cu(OH)2 = CuO + H2O Реакции обмена AgNO3 + KCl = AgCl + KNO3 NaOH + HNO3 = NaNO3 + H2O
B Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений и передача электронов от одних соединений к другим: 2Mg0 + O20 = 2Mg+2O-2 2KI-1 + Cl20 = 2KCl-1 + I20 Mn+4O2 + 4HCl-1 = Mn+2Cl2 + Cl20 + 2H2O Такие реакции называются окислительно - восстановительными. Степень окисления — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна. Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные. Степень окисления - формальное понятие; в ряде случаев степень окисления не совпадает с валентностью. Например: N2H4 (гидразин)
степень окисления азота – -2; валентность азота – 3.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 191; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.75.227 (0.004 с.) |