
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.Содержание книги
Поиск на нашем сайте
Т. е. для реакции аА + bВ + dD +... → еЕ +... можно записать
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л. Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени. В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков. Влияние концентрации реагентов и продуктов реакции Зависимость скорости химических реакций от концентрации определяется законом действующих масс. Закон действующих масс (ЗДМ) Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам. Следует обратить внимание, что концентрация продуктов реакции не влияет на скорость реакции! Из написанного выше уравнения видно, что скорость реакции возрастает при увеличении концентрации реагентов. ВЛИЯНИЕ ДАВЛЕНИЯ В ГАЗОВЫХ РЕАКЦИЯХ На скорость реакций, протекающих в газовой фазе, существенное влияние оказывает давление. Вспомним уравнение Менделеева–Клайперона:
p⋅V=n⋅R⋅T, где p — давление в системе, атм; V — объем газа, л; n — количество вещества, моль; R — универсальная газовая постоянная, 0,0821 л·атм/моль·K; T — температура, К. Проделав несколько арифметических операций: p=nV⋅R⋅T p=C⋅R⋅T C=pR⋅T, убедимся, что давление газа прямо пропорционально его концентрации. То есть с увеличением давления растёт и концентрация газа. Следовательно, скорость гомогенных газовых реакций растёт с увеличением давления. Влияние температуры на скорость реакции В XIX в. голландским учёным Якобом Хендриком Вант-Гоффом была обнаружена эмпирическая закономерность, которую теперь называют правилом Вант-Гоффа. Правило Вант-Гоффа При повышении температуры на каждые 10∘С скорость большинства химических реакций увеличивается в 2–4 раза.
Для гетерогенных реакций (то есть реакций, протекающих с участием веществ в двух или более разных агрегатных состояниях) уравнение скорости реакции учитывает площадь соприкосновения частиц:
где S — площадь соприкосновения частиц, мм2, Δn — изменение количества веществ, вступивших или образовавшихся в ходе реакции, моль; Δt — промежуток времени, с; Vгетер. — скорость гетерогенной реакции, мольмсмольм2⋅с. Соответственно, для увеличения скорости реакции нужно увеличить площадь соприкосновения веществ. Сделать это можно следующим образом: · твёрдые вещества — измельчить (до гранул, стружки, порошка, мелкодисперсного порошка); · жидкости — распылить. Площадь соприкосновения реагентов зависит и от их агрегатного состояния: жидкости реагируют друг с другом с максимальной скоростью, твёрдое вещество с жидкостью реагирует медленнее, и наконец минимальная скорость взаимодействия наблюдается для взаимодействия двух твёрдых веществ.
|
|||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 211; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.172.179 (0.006 с.) |

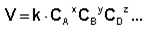 (II.4)
(II.4) ,
,


