
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
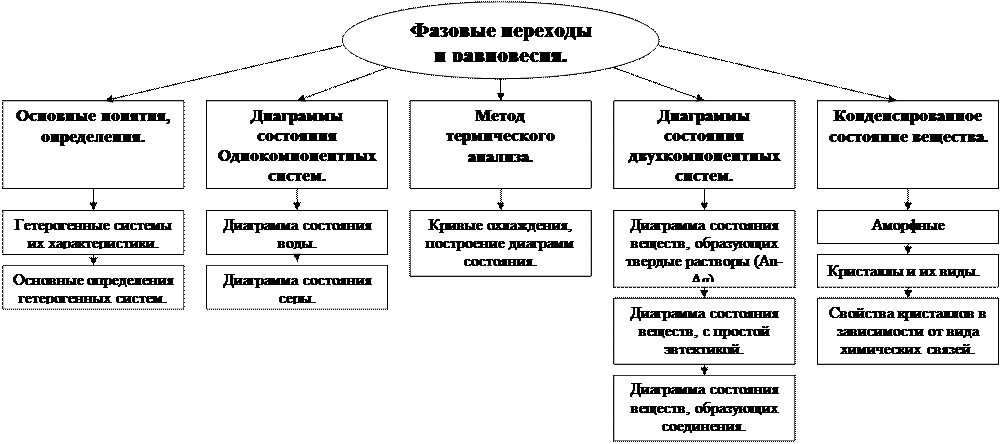
Фаза. Компонент. Число степеней свободы. Правило фаз Гиббса⇐ ПредыдущаяСтр 16 из 16
Основные понятия и определения. Структура темы Почти все ТДС, окружающие нас – гетерогенные. Да и мы сами такие же. Вещество при изменении давления и температуры может переходить из одного агрегатного состояния в другое. Эти переходы, совершающиеся при постоянной температуре, называют фазовыми переходами первого рода. Количество теплоты, которое вещество получает из окружающей среды либо отдает окружающей среде при фазовом переходе, есть скрытая теплота фазового перехода λфп. Если рассматривается гетерогенная система, в которой нет химических взаимодействий, а возможны лишь фазовые переходы, то при постоянстве температуры и давления в системе существует т.н. фазовое равновесие. Фазовое равновесие характеризуется некоторым числом фаз, компонентов и числом степеней термодинамической свободы системы. Гетерогенная система - неоднородная система, состоящая из однородных частей (фаз), разделенных поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам. Число веществ (компонентов), термодинамических фаз и степеней свободы связаны правилом фаз. Примерами гетерогенных систем могут служить: жидкость — насыщенный пар; насыщенный раствор с осадком; многие сплавы. Твердый катализатор в токе газа или жидкости тоже гетерогенная система (гетерогенный катализ). Фаза – гомогенная часть гетерогенной системы, в которой все компоненты равномерно распределены друг относительно друга. Компонент – химически однородная составная часть системы, которая может быть выделена из системы и существовать вне её. Число независимых компонентов системы равно числу компонентов минус число возможных химических реакций между ними. Число степеней свободы – число параметров состояния системы, которые могут быть одновременно произвольно изменены в некоторых пределах без изменения числа и природы фаз в системе. Равновесие фаз - состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механического и химического равновесия (равновесие жидкости со своим насыщенным паром, равновесие воды и льда при температуре плавления). Фазовые переходы (фазовые превращения) - переходы вещества из одной термодинамической фазы в другую, происходящие при изменении температуры, давления или под действием каких-либо других внешних факторов (например, магнитных или электрических полей).
Фазовые переходы бывают: 1-го рода (сопровождаются скачкообразным изменением плотности и энтропии вещества), 2-го рода (плотность и энтропия вещества меняются непрерывно в точке перехода, а теплоемкость, сжимаемость и другие подобные величины претерпевают скачок). Структура темы
Химический потенциал В открытых системах изменение внутренней энергии
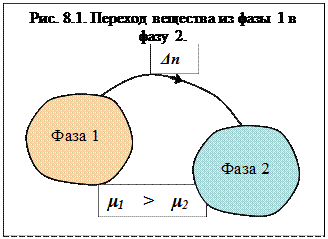
где ΔG энергия Гиббса, Химический потенциал – интенсивный параметр состояния. В условиях, μi = (∂G/∂ni)P,T, i ≠j Если в системе Химический потенциал зависит от парциального давления компонента (для газов) или от его концентрации в растворе: μi = μio+ RTlnpi; μi = μio+ RTlnci, здесь μio стандартное значение химического потенциала, полученное при стандартных условиях и единичных концентрациях или давлениях. Рассмотрим химически однородную гетерогенную систему (состоящую из одного компонента). Пусть в этой системе имеется граница раздела между фазами 1 и 2 (рис. 5.6). Если из фазы 1 в фазу 2 переходит
ΔG = -μ 1 Δn + μ 2 Δn Для того чтобы фазовый переход произошел ΔG < 0, что возможно при условии: -μ 1 Δn + μ 2 Δn < 0, или μ 1 > μ 2 Отсюда следует вывод – фазовый переход компонента осуществляется из фазы с большим химическим потенциалом в фазу с меньшим.
Равновесие между фазами возможно только в том случае, когда химические потенциалы компонента в этих фазах равны:
Данный вывод можно распространить для общего случая перехода вещества из какой-либо системы в окружающую среду (открытые системы) и записать его так: Независимо от числа компонентов открытой системы возможен переход любого из них в другую фазу окружающей среды и, наоборот, при условии выравнивания химических потенциалов этого компонента в фазах системы и среды. При равенстве химических потенциалов наступает равновесие между фазами – сколько вещества уходит из системы, столько же и возвращается. Диаграммы состояния Системы принято классифицировать по числу компонентов (одно-, двухкомпонентные и т.д.), по числу фаз (одно-, двухфазные и т.д.) и числу степеней свободы (инвариантные, моно-, дивариантные и т.д.). Для систем с фазовыми переходами обычно рассматривают графическую зависимость состояния системы от внешних условий – т.н. диаграммы состояния. Число степеней свободы (правило фаз Гиббса) Число степеней свободы гетерогенной термодинамической системы, находящейся в состоянии фазового равновесия, определяется правилом фаз, сформулированным Дж. Гиббсом: Число степеней свободы равновесной термодинамической системы С равно числу независимых компонентов системы К минус число фаз Ф плюс число внешних факторов, влияющих на равновесие. Для системы, на которую из внешних факторов влияют только температура и давление, можно записать: С = К – Ф + 2 (8.1) Анализ диаграмм состояния позволяет определить число фаз в системе, границы их существования, характер взаимодействия компонентов. В основе анализа диаграмм состояния лежат два принципа: принцип непрерывности и принцип соответствия. Согласно принципу непрерывности, при непрерывном изменении параметров состояния все свойства отдельных фаз изменяются также непрерывно; свойства системы в целом изменяются непрерывно до тех пор, пока не изменится число или природа фаз в системе, что приводит к скачкообразному изменению свойств системы. Согласно принципу соответствия, на диаграмме состояния системы каждой фазе соответствует часть плоскости – поле фазы. Линии пересечения плоскостей отвечают равновесию между двумя фазами. Всякая точка на диаграмме состояния (т. н. фигуративная точка) отвечает некоторому состоянию системы с определенными значениями параметров состояния. Правило справедливо при следующих предположениях: 1) фазы имеют достаточно большие размеры, так что поверхностными явлениями можно пренебречь; 2) каждый компонент может проходить через поверхности раздела фаз (полупроницаемые перегородки отсутствуют).
|
||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 3460; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.108.11 (0.012 с.) |
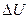 происходит не только в результате получения или отдачи теплоты и совершения работы, но и за счёт изменения масс, входящих в систему компонентов. Все свойства открытых систем и ΔG будут зависеть от количества каждого компонента:
происходит не только в результате получения или отдачи теплоты и совершения работы, но и за счёт изменения масс, входящих в систему компонентов. Все свойства открытых систем и ΔG будут зависеть от количества каждого компонента: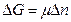 ,
,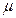 – химический потенциал,
– химический потенциал, 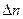 – изменённое количество вещества системы выраженное в молях.
– изменённое количество вещества системы выраженное в молях.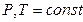 и сохранения количеств всех других компонентов, μ равен частной производной энергии Гиббса по количеству компонента:
и сохранения количеств всех других компонентов, μ равен частной производной энергии Гиббса по количеству компонента: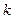 – компонентов, то
– компонентов, то  .
.
 .
.


