
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гальванические элементы и их электродвижущая сила.
Устройство, в котором энергия химической реакции непосредственно превращается в электрическую энергию, называется гальваническим элементом. Гальванический элемент состоит из двух соприкасающихся друг с другом растворов электролитов, в которые погружены металлические пластинки — электроды, соединённые между собой внешним проводником. Гальванический элемент, дающий электрический ток, находится в неравновесном состоянии. С уменьшением силы тока разность потенциалов между электродами возрастает. Если сила тока бесконечно мала и система практически находится в состоянии равновесия, элемент этот работает обратимо. Максимальная разность потенциалов, достигаемая при обратимой работе гальванического элемента, называется его электродвижущей силой (эдс). Элемент называется необратимым, если в системе хотя бы один из процессов является термодинамически необратимым. В качестве обратимого гальванического элемента рассмотрим элемент Якоби — Даниеля, который состоит из медного и цинкового электродов, погруженных соответственно в растворы CuSO4 и ZnSO4. Схематически этот элемент изображается следующим образом:
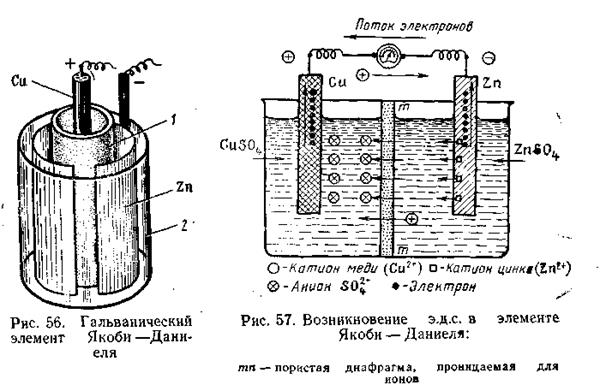
Здесь поверхность раздела двух фаз, между которыми имеет место скачок потенциала, обозначена вертикальной линейкой. Двойная линейка означает, что в месте соприкосновения двух растворов скачок потенциала, обусловленный различной скоростью диффузии ионов (так называемый диффузионный потенциал), снят и его можно не учитывать при вычислении эдс этого элемента. Металл с большей величиной стандартного потенциала (положительный электрод) принято писать слева, а с меньшей величиной (отрицательный электрод)—справа. Общий вид гальванического элемента Якоби — Даниеля показан на рис. 4.10. В пористом сосуде 1 находится раствор CuSO4, в который погружен медный электрод. Этот сосуд помещён в стеклянную банку 2, содержащую цинковый электрод, находящийся в растворе ZnSO4. На границе раздела фаз металл — жидкость образуется двойной электрический слой, при этом поверхность металла заряжается отрицательно, прилегающий слой — положительно. При разомкнутой цепи процесс растворения цинка быстро достигает равновесного состояния и приостанавливается. Если цинковый электрод соединить каким-либо проводником с медным электродом, будет наблюдаться совершенно иная картина (рис. 4.11).
В этом случае избыточные электроны с цинкового электрода потекут на медный, и во внешней цепи возникнет электрический ток, который можно измерить c помощью гальванометра. Электроны, перешедшие на медь, нейтрализуют осадившиеся на ней из раствора CuSO4 ионы Сu2+, превращая их в электронейтральные атомы меди. Остающиеся свободными сульфат-ионы через пористые стенки сосуда 1 проникают во внешнюю жидкость и, соединяясь с катионами Zn2+ металлического цинка, дают ZnSO4. С другой стороны, катионы цинка в процессе работы гальванического элемента также диффундируют из сосуда 2 через пористую перегородку в сосуд 1, замещая там перешедшие на медную пластинку катионы Сu2+. В результате этого раствор CuSO4 в сосуде 1 постепенно превращается в ZnSO4. По мере удаления по внешней цепи с цинковой пластинки избытка электронов все новые количества катионов Zn2+ будут переходить в раствор. Гальванический элемент будет работать до тех пор, пока весь цинковый электрод не растворится, т. е. перейдёт в состояние катионов Zn2+. После этого электрический ток прекращается. При работе гальванического элемента происходит одновременный перенос электричества по двум цепям: внешней (поток электронов по проволоке) и внутренней (поток катионов в жидкой фазе элемента). Как видно из рис. 4.11, цинк для внешней цепи играет роль катода (посылает во внешнюю цепь отрицательно заряженные электроны), а для внутренней цепи — анода (посылает во внутреннюю цепь положительно заряженные катионы). Медь для внешней цепи играет роль анода (акцептор электронов), а для внутренней — роль катода (акцептор электронов). Гальваническая цепь может быть составлена из пар самых разнообразных металлов, из которых каждый погружен в раствор своей соли. Например:
Э.д.с. всех гальванических элементов слагается из величин потенциалов, возникающих на всех границах раздела. Без учёта диффузионного потенциала основное уравнение э.д.с. будет иметь вид
где Е — э.д.с. гальванического элемента, ε1 и ε2 — электродные потенциалы. Э.д.с. любого гальванического элемента равна разности его электродных потенциалов. Уравнение (4.91) широко используется в электрохимии, и на нем основаны все расчёты, связанные с работой гальванических элементов. В качестве примера рассмотрим, чему будет равняться э.д.с. только что рассмотренного гальванического элемента Якоби — Даниеля, если концентрации (активности) ионов цинка и меди равны между собой, т. е. аZn2+ = αCu2+ наглядности расчёта запишем эту цепь:
На основании уравнения (4.91) э.д.с. этой цепи будет равна:
Используя уравнение Нернста, можем записать
С учётом этого уравнение (4.91) может быть представлено так:
Поскольку по условию задачи aCu2+ = aZn2+, уравнение (4.94) ещё более упростится:
Э.д.с. гальванического элемента, составленного из двух разных электродов, но с одинаковой концентрацией (активностью) их солей, равна разности стандартных потенциалов этих элементов. Подставляя численные значения
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 165; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.125.171 (0.008 с.) |
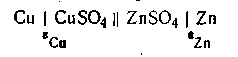
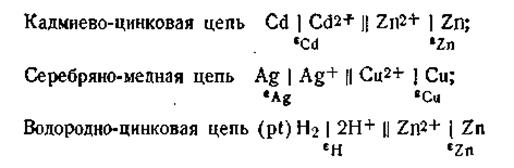
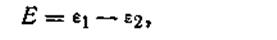
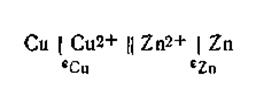
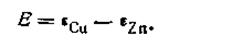
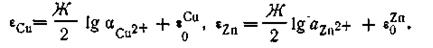

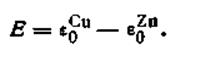
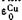 и
и 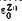 , получим E=+0,34—(—0,76)=1,1 В. Опыт показывает, что эта величина очень хорошо совпадает с экспериментально найденной э.д.с. медно-цинкового элемента.
, получим E=+0,34—(—0,76)=1,1 В. Опыт показывает, что эта величина очень хорошо совпадает с экспериментально найденной э.д.с. медно-цинкового элемента.


