
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теплоёмкость истинная и средняя, изобарная и изохорная. Уравнение Кирхгофа.
Теплоёмкостью называют количество теплоты, поглощаемое единицей массы вещества при нагревании на один градус. За единицу массы принимают 1г(кг) или 1 моль. Истинная теплоёмкость Средняя теплоёмкость Из (1) следует V=const P=const Для 1 моль идеального газа В дифференциальной форме уравнение Кирхгофа Интегрирование уравнения Кирхгоффа. Зависимость теплового эффекта от температуры. Интегрирование уравнения Кирхгоффа. Зависимость теплового эффекта от температуры.
Для реакции А→ В известен тепловой эффект при Т1
• Тепловой эффект при Т2
По закону Гесса
Где Т1 = 298К
Термодинамически обратимые и необратимые процессы. II закон термодинамики. Термодинамически обратимые процессы Самопроизвольные процессы - процессы, которые совершаются в системе без вмешательства со стороны окружающей среды. Термодинамически обратимый процесс - процесс, допускающий возможность возвращения системы в исходное состояние без изменения в самой системе и в окружающей среде. Термодинамическое понятие обратимого процесса связано не с направлением процесса, а с определенным способом его проведения.
При равновесии
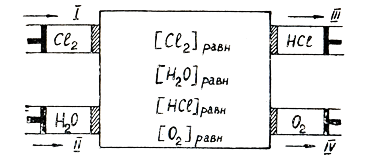
Если 2) Передача тепла Химическая реакция 2Сl2(г) + 2H2O(г) = 4HCl (г) +O2(г)
Ящик Вант-Гоффа P,T=const
Реальные процессы (расширение газа, передача тепла, хим. реакция) определенных условиях можно провести термодинамически обратимо. II начало термодинамики: · Томпсон: Невозможна периодически действующая машина, единственным результатом которой было бы получение работы за счёт охлаждения теплового резервуара. · Оствальд: Невозможно создание вечного двигателя 2-го рода.
Изменение энтропии химической реакции. Зависимость изменения энтропии реакции от температуры. Изменение энтропии при нагревании, расширении идеального газа и при фазовых переходах Для идеального газа Процесс нагревания (охлаждения) V= const Интегрируя, получим P=const 2. Процесс расширения (сжатия) T=const
3. Фазовые превращения (плавление, испарение, возгонка)
Изменение энергии Гиббса как критерий самопроизвольного протекания процесса. Зависимость энергии Гиббса системы от её состава
При Для индивидуального вещества химический потенциал совпадает с энергией Гиббса 1 моль этого вещества.
Константа равновесия реакции. Уравнение изобары химической реакции. Его анализ.
|
|||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 187; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.13.173 (0.01 с.) |
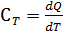 (1)
(1) (2)
(2)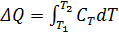 , подставляя в (2), получим
, подставляя в (2), получим 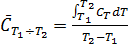
 и
и 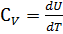
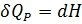 и
и 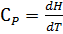
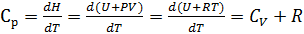
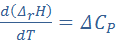

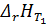
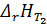 =?
=?
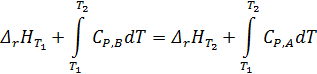
 (1)
(1)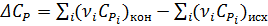

 или
или 
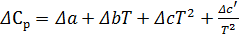
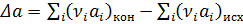
 и т.д.
и т.д.
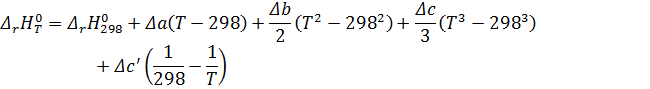


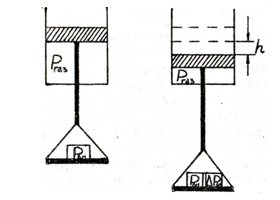 1) механический процесс
1) механический процесс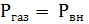
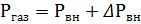

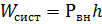
 (1) и
(1) и 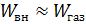
 (2)
(2)
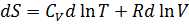 или
или 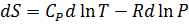
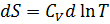
 или
или 
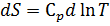
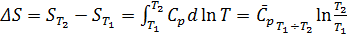
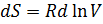
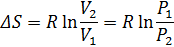
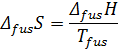

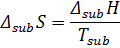
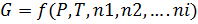
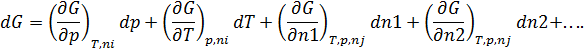
 -- химический потенциал, работа по переносу 1 моль вещества
-- химический потенциал, работа по переносу 1 моль вещества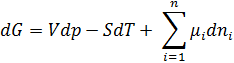
 и
и  энергия Гиббса изменяется за счёт изменения состава система
энергия Гиббса изменяется за счёт изменения состава система 



