Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В 1 части лабораторного практикума представлен материал,Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Оглавление
Предисловие. 535 Часть 1. 536 Учебный модуль 1 – Анатомия семенных растений. 536 Модульная единица 1 Растительная клетка. 536 Лабораторная работа № 1. Строение растительных клеток. 536 Работа 1 Строение клетки эпидермы сочной чешуи луковицы лука репчатого - állium cépa L. 541 Работа 2 Хлоропласты в клетках листа мха мния остроконечного - Mníum cuspidátum Hedw. Формы клеток. 542 Работа 3 Хромопласты в клетках зрелых плодов. 543 Работа 4 Лейкопласты в клетках эпидермы листа зебрины повислой - Zébrina péndula Schnizl. 544 Работа 5 Крахмальные зёрна. 545 Работа 6 Выявление растительных масел в семенах. 546 Работа 7 Запасные вещества в клетках эндосперма зерновки пшеницы.. 546 Работа 8 Инулин в клетках клубня подсолнечника клубненосного, или Топинáмбура - Heliá nthus tuberó sus L. 548 Лабораторная работа № 2. Состав клеточного сока. 549 Работа 9 Пигменты клеточного сока. 549 Работа 10 Выявление дубильных веществ с помощью солей железа. 549 Работа 11 Кристаллы оксалата кальция. 549 Лабораторная работа № 3 Клеточная стенка. 551 Работа 12 Строение клеточной стенки. 551 Работа 13 Реакции на вещества клеточной стенки. 552 Работа 14 Митоз в клетках кончика корня лука репчатого - Állium cépa L. 553 Вопросы для самоконтроля и подготовки к коллоквиуму по темам модульной единицы 1 "Растительная клетка". 555 Модульная единица 2 Ткани высших растений. 557 Лабораторная работа № 4. Меристематические и покровные ткани. 557 Работа 15 Первичная меристема верхушки побега элодеи канадской - Elodéa canadénsis Michx. 557 Работа 16 Эпидерма листа. 559 Работа 17 Волоски (трихомы) эпидермы.. 560 Работа 18 Пробка в составе покровных комплексов. 560 Лабораторная работа № 5. Механические ткани. 562 Работа 19 Механические ткани стебля тыквы обыкновенной - Cucúrbita pépo L. 563 Работа 20 Волокна на продольном срезе стебля льна обыкновенного - Línum usitatíssimum L. 564 Работа 21 Склереиды в плоде груши обыкновенной - Pýrus commúnis L. 564 Лабораторная работа № 6. Проводящие ткани. Проводящие пучки. 565 Работа 22 Проводящие ткани в стебле тыквы обыкновенной - Cucúrbita pépo L. 565 Работа 23 Закрытый коллатеральный пучок на поперечном срезе стебля кукурузы обыкновенной - Zéa máys L. 568 Работа 24 Открытый биколлатеральный пучок на поперечном срезе стебля тыквы обыкновенной - Cucúrbita pépo L. 568 Работа 25 Концентрические пучки на поперечных срезах корневищ ландыша майского (Convallá ria majá lis L.) и папоротника-орляка (Pterí dium aquilí num (L.) Kuhn ex Decken) 569 Вопросы для самоконтроля и подготовки к коллоквиуму по темам модульной единицы 2 "Ткани высших растений". 571 Учебный модуль 2 – Морфология семенных растений. 574 Модульная единица 3 Вегетативные органы растений. 574 Лабораторная работа № 7. Корень. Макро- и микроскопическое строение корня 574 Работа 26 Структурно-функциональные зоны растущего корня. 575 Работа 27 Первичное анатомическое строение корня. 576 Работа 28 Вторичное строение корня. 578 Работа 29 Морфология корнеплодов. 580 Работа 30 Анатомическое строение монокамбиальных корнеплодов. 581 Работа 31 Анатомическое строение поликамбиального корнеплода свёклы обыкновенной - Béta vulgáris L. 581 Работа 32 Клубеньки на корнях люпина многолистного - Lupínus polyphýllus Lindl. 584 Лабораторная работа № 8. Строение стебля однодольных и двудольных трав 584 Работа 33 Строение стебля кукурузы обыкновенной - Zéa máys L. 587 Работа 34 Строение соломины ржи посевной - Secále cereále L. 588 Работа 35 Пучковое строение стебля на поперечном срезе стебля клевера лугового - Trifólium praténse L. 589 Работа 36 Переходное строение стебля на поперечном срезе стебля подсолнечника однолетнего - Heliánthus ánnuus L. 590 Работа 37 Сплошное строение стебля на поперечном срезе стебля льна обыкновенного - Línum usitatíssimum L. 591 Лабораторная работа № 9. Строение стебля древесных растений. 593 Работа 38 Строение стебля древесных двудольных растений. 593 Работа 39 Рассеяннососудистая древесина стебля яблони домашней - Málus doméstica Borkh. 595 Работа 40 Строение стебля хвойного растения. 596 Лабораторная работа № 10. Морфология и анатомия листа. 598 Работа 41 Изучение морфологии листьев. 601 Работа 42 Листья с гетерогенным мезофиллом. Строение дорсовентрального листа. 601 Работа 43 Листья с гомогенным мезофиллом (изопалисадным) 603 Лабораторная работа № 11. Морфология побега. 607 Работа 44 Изучение морфологии побегов. 607 Работа 45 Изучение строения и расположения почек. 609 Работа 46 "Выводковые" почки как специализированные органы вегетативного размножения. 610 Работа 47 Метаморфозы надземных побегов. 611 Работа 48 Метаморфозы подземных побегов. 613 Вопросы для самоконтроля и подготовки к коллоквиуму по темам модульной единицы 3 "Вегетативные органы растений". 618 Модульная единица 4 "Размножение и воспроизведение растений". 622 Лабораторная работа № 12. Отдел Покрытосеменные. Соцветия. Цветок. 622 Работа 49 Разнообразие строения околоцветника. 624 Лабораторная работа № 13. Андроцей. Гинецей. 627 Работа 50 Строение тычинки. 628 Работа 51 Анатомическое строение пыльника. 629 Работа 52 Строение пестика. 631 Работа 53 Типы гинецея. 632 Лабораторная работа № 14. Типы семязачатков. Зародышевый мешок. 632 Работа 54 Семязачаток. 632 Работа 55 Составление формул и диаграмм цветков. 635 Работа 56 Соцветия. 639 Лабораторная работа № 15. Семя. Плод. Классификации семян и плодов. 640 Работа 57 Строение семени фасоли обыкновенной - Phaséolus vulgáris L. 641 Работа 58 Строение семени злаков. 642 Работа 59 Проростки. 644 Работа 60 Простые плоды.. 647 Работа 61 Сборные плоды и соплодия. 652 Вопросы для самоконтроля и подготовки к коллоквиуму по темам модульной единицы 4 "Вегетативные органы растений". 655 Часть 2. 656 Учебный модуль 3 "Систематика растений". 657 Модульная единица 5 "Низшие растения". 657 Лабораторная работа № 16. Водоросли. Отдел Зеленые водоросли – Chlorophyta 657 Работа 62. Хлорелла – Ch lorella sp. 657 Работа 63. Хламидомонада – Ch lamydomonas sp. 657 Работа 64. Спирогира – Spirogyra sp. 657 Работа 65. Хара – Charales sp. 658 Модульная единица 6 "Высшие споровые растения". 659 Лабораторная работа № 17. Моховидные. Плауновидные. 659 Работа 66. Политрихум обыкновенный, или Кукушкинлен - Polytrichum commune. 659 Работа 67. Спорофит (спорогон) Кукушкина льна - Polytrichum commune 660 Работа 68. Сфагнум – Sphagnum sp. 660 Работа 69. Плаун булавовидный - Lycopodium clavatum.. 661 Работа 70. Селагинелла – Selaginella sp. 662 Лабораторная работа № 18. Хвощевидные. Папоротниковидные. 663 Работа 71. Хвощ полевой – Equisetum arvense, спороносный колосок. 663 Работа 72. Хвощ полевой – Equisetum arvense, заростки. 664 Работа 73. Щитовник мужской – Dryopteris filix- mas, строение сегмента вайи на поперечном срезе. 664 Работа 74.Страусник обыкновенный - Matteuccia struthiopteris, строение сегмента вайи на поперечном срезе. 665 Работа 75. Гаметофит Щитовника мужского - Dryopteris filix- mas 665 Модульная единица 7 "Семенные растения". 665 Лабораторная работа № 19. Голосеменные. 665 Работа 76. Верхняя часть многолетнего побега Сосны обыкновенной – Pinus sylvestris 665 Работа 77. Продольный срез пыльниковой шишки и микроспорофилл с пыльниками Сосны обыкновенной – Pinus sylvestris 666 Работа 78. Развитие пыльцевого зерна (мужского гаметофита) у Сосны обыкновенной – Pinus sylvestris 667 Работа 79. Мегаспорогенез и онтогенез семязачатка у Сосны обыкновенной – Pinus sylvestris 667 Работа 80. Образование семени из семязачатка у Сосны обыкновенной – Pinus sylvestris 668 Вопросы для самоконтроля и подготовки к коллоквиуму по темам модульных единиц 5 "Низшие растения", 6 "Высшие споровые растения" и 7 "Семенные растения: Голосеменные растения". 669 Систематика цветковых. 670 Сравнительная характеристика классов Двудольных и Однодольных. 670 План характеристики семейства. 672 Лабораторная работа № 20. Методика определения растений. Семейство Лютиковые. 673 Работа 81. Определение видов семейства Лютиковые. 673 Лабораторная работа № 21. Семейства Капустные и Тыквенные. 678 Работа 82. Определение видов семейства Крестоцветные – Cruciferae, или Капустные – Brassicaceae. 678 Работа 83. Определение растений семейства Тыквенные – Cucurbitaceae. 680 Лабораторная работа № 22. Семейство Розовые. 682 Работа 84. Определение растений семейства Розанные - Rosaceae. 682 23.1. Подсемейство Spiraeoideae - Спирейные. 683 23.2. Подсемейство Rosoideae – Шиповниковые. 683 23.3. Подсемейство Pomoideae - Яблоневые. 684 23.4. Подсемейство Prunoideae – Сливовые. 685 Лабораторная работа № 23. Семейство Бобовые. 686 Работа 85. Определение растений семейства Бобовые - Fabaceae. 686 Лабораторная работа № 24. Семейства Сельдерейные, Маревые. 689 Работа 86. Определение растений семейства Сельдерейные. 689 Работа 87. Определение растений семейства Маревые - Chenopodiaceae. 691 Лабораторная работа № 25. Семейства Пасленовые, Яснотковые. 693 Работа 88. Определение растений семейства Пасленовые - Solanaceae. 693 Работа 89. Определение растений семейства Яснотковые. 695 Лабораторная работа № 26. Семейство Сложноцветные – Compositae, или Астровые - Asteraceae. 697 Работа 90. Определение растений семейства Семейство Сложноцветные (Астровые) – Compositae (Asteraceae) 697 Лабораторная работа № 27. Семейство Лилейные. 700 Работа 91. Определение растений семейства Лилейные – Liliaceae. 700 Лабораторная работа № 28. Семейства Осоковые и Злаки. 703 Работа 92. Определение растений семейства Мятликовые – Poaceae, или Злаки - Gramineae. 703 Работа 93. Определение растений семейства Осоковые - Cyperaceae. 708 Учебный модуль 4 "География и экология растений". 711 Модульная единица 9 "Экология растений". 711 Лабораторная работа № 29. Классификация экологических факторов. Свет и температура как экологические факторы.. 711 Работа 94. Анатомические адаптации растений к световому режиму. 711 Работа 95. Анатомические адаптации растений к термическим условиям. 714 Лабораторная работа № 30. Вода как экологический фактор. 717 Работа 96. Анатомические адаптации растений к условиям увлажнения. 717 Лабораторная работа № 31. Засоление как экологический фактор. Экологические группы растений относительно режимов этого фактора. 727 Работа 97. Анатомические адаптации растений к сильному почвенному засолению.. 727 Указатель источников рисунков к "Лабораторному практикуму по ботанике" 731 Предисловие Лабораторный практикум представляет собой пособие к занятиям по курсу ботаники. Лабораторные занятия по анатомии и морфологии проходят параллельно с чтением лекций. Эти два вида учебного процесса тесно связаны друг с другом, однако лабораторные занятия имеют собственное содержание и собственные задачи. На них следует, как можно более подробно ознакомить студентов с конкретными объектами и привить им навыки анализа ботанического материала с помощью микроскопа. Практикум также предназначен для предварительной домашней подготовки студентов с целью наиболее экономичного использования времени занятий с преподавателем. Относительная автономия лабораторно-практического курса обусловила его построение: каждая тема предваряется определением основных понятий, затем следует подробное описание содержания и последовательности выполнения задания. При подборе объектов основное внимание уделялось растениям, используемым в сельскохозяйственном производстве или имеющих важное значение для понимания процессов эволюции. В практикуме приведены как оригинальные рисунки, используемые коллективом кафедры ботаники РГАУ-МСХА, так и взятые и из различных учебников и пособий: Андреева И.И., Родман Л.С. Ботаника. - М.: Колос, 2002. В.Ф. Раздорский. Анатомия растений, М.: Советская наука, 1949. Родман Л.С. Ботаника. – М.: Колос, 2001. Хржановский В.Г. Курс общей ботаники. Ч. 1, 2. - М.: Высшая школа, 1989. Хржановский В.Г., Пономаренко С.Ф. Практикум по курсу общей ботаники. - М.: Высш. школа, 1990.
Часть 1
Изучаемый в первом семестре Временные препараты При изготовлении временных препаратов изучаемый объект помещают на предметное стекло в каплю воды или глицерина, раствора реактива или красителя и накрывают покровным стеклом. Такой препарат можно хранить от получаса до месяца. Препараты, которые хранятся более длительный срок, называют постоянными. Некоторые органы растений, как, например, споры, листья некоторых видов и др., можно рассматривать в микроскоп целиком (in toto),без предварительного приготовления срезов. Чаще приходится делать срезы органов, подлежащих изучению. Срезы изготовляют из свежих частей растений или фиксированных. Обычно для фиксации употребляют растворы спирта или формалина. Срезы делают при помощи бритвы. При изготовлении временных препаратов соблюдают следующую последовательность операций. Моют и тщательно вытирают предметное и покровное стёкла. Чтобы не сломать очень хрупкое покровное стекло, его споласкивают в воде, помещают в складку полотенца между большим и указательным пальцами правой руки и осторожно вытирают круговыми движениями пальцев. Наносят на предметное стекло каплю жидкости (воды, глицерина, раствора реактива или красителя). Делают срез изучаемого органа при помощи бритвы. Выбрав самый тонкий срез, кладут его на предметное стекло в каплю жидкости. Накрывают срез покровным стеклом так, чтобы под него не попал воздух. Для этого покровное стекло берут двумя пальцами за боковые края, затем касаются нижним краем стекла границы капли жидкости и плавно опускают стекло. Если жидкости много и она вытекает из-под покровного стекла, удаляют избыток её кусочком фильтровальной бумаги. Если же под покровным стеклом остались места, заполненные воздухом, добавляют жидкость, поместив каплю её рядом с краем покровного стекла. Тема Растительная клетка Основные понятия. Растительные клетки отличаются от клеток других эукариот наличием пластид, жестких полисахаридных клеточных стенок, крупных вакуолей с клеточным соком и отсутствием у большинства центриолей при делении. Многообразие форм клеток сводят к двум основным типам. Паренхимные клетки - изодиаметрические многогранники; диаметр их примерно одинаков во всех направлениях. Прозенхимные клетки - вытянутые; длинна одного из диаметров в 5..., 10..., 100... и более раз превышает остальные.
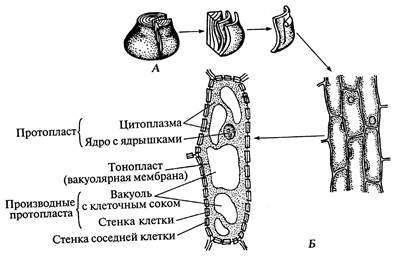
Цитоплазма и ядро составляют живое содержимое клетки - протопласт. В протопласте осуществляются все основные процессы обмена веществ. Клеточная стенка и клеточный сок - производные протопласта, продукт его жизнедеятельности.
Работа 1 Строение клетки эпидермы сочной чешуи луковицы лука репчатого - állium cépa L.
Порядок работы: Изготовить временный препарат, сняв пинцетом или препарировальной иглой кожицу с выпуклой стороны сочной чешуи луковицы и поместив на предметное стекло в каплю J+KJ (реактив на белок). Белки цитоплазмы окрасятся в желтый цвет, белки ядра - в тёмно-жёлтый. Накрыть покровным стеклом. Рассмотреть при малом увеличении участок эпидермы, состоящий из одного слоя клеток с хорошо заметными ядрами. Перевести микроскоп на большое увеличение и изучить строение клетки. Найти: - стенки клеток с простыми порами; - зернистую цитоплазму с ядром; - одно или несколько ядрышек в ядре; - вакуоль с клеточным соком. Зарисовать 1 - 2 клетки и обозначить их основные части (рис. 2).
Рис. 2. Клетки эпидермы сочной чешуи луковицы лука репчатого - á llium c é pa L.: А - луковица лука; Б - клетки эпидермы. Цитоплазма, ядро, ядрышко - протопласт; стенка клетки, вакуоль, мембраны - производные протопласта
Тема Пластиды Для высших растений характерны три типа пластид. В них происходит первичный и вторичный синтез углеводов. По окраске различают: зелёные – хлоропласты, органеллы фотосинтеза, жёлто-оранжевые и красные – хромопласты, окрашивающие лепестки цветков и плоды и бесцветные - лейкопласты, в которых накапливаются запасные питательные вещества (в основном крахмал). Обычно в клетке встречается только один тип пластид. Световой микроскоп не позволяет рассмотреть сложную мембранную структуру пластид.
Работа 2 Хлоропласты в клетках листа мха мния остроконечного - Mníum cuspidátum Hedw. Формы клеток
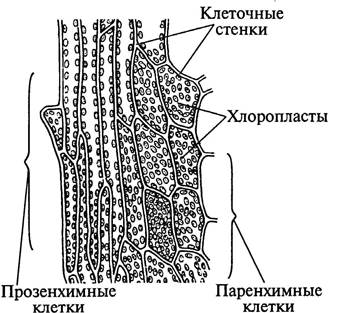
Порядок работы: Изготовить временный препарат. В каплю воды на предметном стекле поместить лист мха и накрыть покровным стеклом. При малом увеличении рассмотреть форму клеток листа. Большая часть листа состоит из паренхимных клеток, по краю листа и его срединной жилке располагаются прозенхимные клетки. Рассмотреть в цитоплазме хлоропласты при малом и большом увеличении. Подсчитать число хлоропластов в клетке. Ядра в этих клетках почти не заметны, т.к. бесцветные ядра замаскированы зелёными хлоропластами. Зарисовать паренхимную и прозенхимную клетки с хлоропластами (рис. 3).
Рис. 3. Прозенхимные и паренхимные клетки листа мха мния остроконечного – Mn í um cuspid á tum Hedw.
Работа 5 Крахмальные зёрна
Основные понятия. Форма, величина и структура крахмальных зёрен специфичны для каждого растения. Это свойство широко используют для микроскопического анализа состава муки. В зависимости от числа центров крахмалообразования различают простые (центр крахмалообразования один), сложные (центров крахмалообразования несколько) и полусложные зерна. Последние сначала образуются как сложные, а затем покрываются общими слоями. Порядок работы: Готовят временный препарат. Кусочком клубня картофеля делают мазок по предметному стеклу в капле воды. При этом из разрушенных клеток в воду попадают крахмальные зерна, и она мутнеет. Каплю накрывают покровным стеклом. Препарат рассматривают сначала при малом, затем при большом увеличении. В поле зрения видны крупные и мелкие крахмальные зёрна. Уменьшая освещённость препарата при помощи диафрагмы и конденсора, можно увидеть слоистость зёрен. Она объясняется неодинаковой оводнённостью слоёв зерна. Отмечают, что большинство крахмальных зёрен - простые, стараются найти в поле зрения сложные и полусложные зерна. У картофеля сложные зерна значительно мельче, чем простые. Реактив на крахмал раствор иода в иодистом калии (J2 + KJ). Не снимая со столика, окрашивают препарат. Иодистый калий вызывает набухание крахмальных зерен, а иод окрашивает их в синий цвет. Когда реактив проникнет под покровное стекло, произойдёт голубое окрашивание зёрен. При избытке реактива крахмал окрашивается почти в чёрный цвет. Готовят препараты из муки различных растений: с простыми крахмальными зернами пшеницы или ржи, или кукурузы и сложными - овса или риса. Зарисовать и обозначить типы крахмальных зёрен (рис. 6).
Рис. 6. Крахмальные зерна: А. Из клеток клубня картофеля.
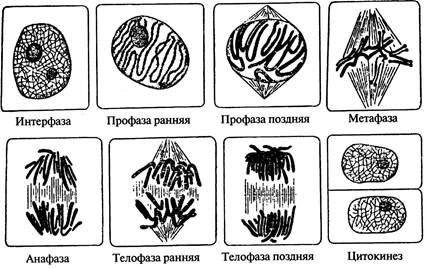
Тема Деление клеток Основные понятия. Амитоз, митоз и мейоз - способы деления клеток. Амитоз - прямое деление интерфазного ядра путём перетяжки без образования хромосом. Амитоз встречается в больных или специализированных, обреченных на гибель клетках. Митоз - универсальная форма деления ядра. Он характерен для соматических (вегетативных) клеток и гамет растений, обеспечивает увеличение их числа; осуществляется в митотическом цикле. Мейоз - происходит при образовании спор; состоит из двух последовательных делений; обоим делениям предшествует одна интерфаза. В процессе мейоза происходит переход от диплоидного набора хромосом к гаплоидному. В интерфазном ядре хромосомы деспирализованы, поэтому под световым микроскопом не видны. Во время деления они спирализуются, укорачиваются и утолщаются, поэтому их можно подсчитать, определить форму и измерить величину.
Работа 14 Митоз в клетках кончика корня лука репчатого - Állium cépa L.
Порядок работы: Постоянный препарат продольного среза кончика корня лука репчатого рассматривают сначала при малом увеличении. Снаружи кончик корня покрыт корневым чехликом, состоящим из вытянутых клеток с небольшими ядрами. Чехликом прикрыта большая группа меристематических клеток, в которой происходят интенсивные митотические деления. Клетки меристемы почти одинаковы по форме, плотно примыкают друг к другу и имеют крупные ядра. Среди меристематических находятся клетки с интерфазными ядрами. В таких клетках в ядре хорошо заметны ядрышки и ядерная оболочка. Клеток в состоянии интерфазы большинство, т.к. она длится во много раз дольше, чем фазы митоза. При большом увеличении рассматривают делящиеся клетки. В непрерывном процессе митотического деления выделяют четыре фазы: профазу, метафазу, анафазу и телофазу. В профазе в ядре отмечают клубок нитей - хромосом, исчезновение ядрышек. В метафазе обращают внимание на отсутствие ядерной оболочки, четкие границы ахроматинового веретена и тёмные, толстые двухроматидные хромосомы, расположенные в экваториальной плоскости клетки. В анафазе происходит деление центромер, и к полюсам отходят однохроматидные хромосомы. Они расходятся благодаря сокращению тянущих нитей и удлинению опорных нитей ахроматинового веретена. На каждом из полюсов становиться столько хромосом, сколько их было в исходной клетке. В телофазе у полюсов клеток видны тёмные сгустки начавших деспирализоваться хромосом. Формируются новые ядра, в которых становятся заметными ядрышки. Вновь появляется ядерная оболочка. В экваториальной плоскости от центра клетки идёт процесс образования клеточной стенки. Таким образом, осуществляется цитокинез. Зарисовать схематически фазы митоза и цитокинез, расположив их последовательно (рис. 11).
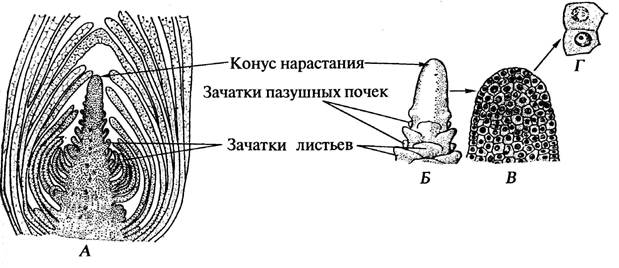
Рис. 11. Фазы митоза и цитокинез в кончике корня лука репчатого - Á llium c é pa L. (схема) Вопросы для самоконтроля и подготовки к коллоквиуму по темам модульной единицы 1 "Растительная клетка" 1. Каков химический состав и физические свойства цитоплазмы? 2. Чем обусловлены осмотические явления в клетке? Что такое тургор? Что такое плазмолиз? 3. Что такое компартментация, в чем ее биологический смысл? 4. Какую роль играет аппарат Гольджи в растительной клетке? 5. Каково строение и функции рибосом, где и как они образуются? 6. Какие органеллы цитоплазмы имеют собственные ДНК и рибосомы? 7. Какова роль пластид в жизни клетки? 8. Каков общий план строения пластид? 9. Как связана структура крахмального зерна (простого, сложного) с субмикроскопическим строением лейкопластов? 10. Какие изменения происходят в структуре пластид при превращении лейкопластов в хлоропласты и хлоропластов в хромопласты? 11. Чем обусловлена форма хромопластов? 12. Каково строение ядра? 13. Каков химизм хроматиновых структур ядра? Каково строение молекул ДНК? 14. Какие процессы происходят в ядре в разные периоды интерфазы? 15. Каково строение хромосом? Остается ли оно неизменным? 16. Как возникают ядрышки и какие они выполняют функции? Является ли ядрышко самостоятельной органеллой ядра? 17. Каковы функции ядра? 18. Что такое гаплоидный и диплоидный набор хромосом? Как называются клетки, ядра которых содержат тройной и более набор хромосом? 19. Каковы химический состав и молекулярная структура клеточной стенки? 20. Каков онтогенез клеточной стенки? Что такое фрагмопласт? 21. Какова роль аппарата Гольджи и плазмалеммы в образовании и росте клеточной стенки? 22. Какой из способов роста клеточной стенки обеспечивает утолщение, а какой — поверхностный ее рост? 23. Какую роль играют клеточные стенки в жизни растения? 24. Как устроены поры и как они образуются? 25. Что такое замыкающая пленка поры и из каких элементов она слагается? 26. Что такое перфорации? Где они встречаются? 27. Какое влияние на протопласт оказывают разные видоизменения клеточной стенки? 28. Как называется и чем обусловливается процесс разъединения тканей на отдельные клетки? Где это явление встречается в естественных условиях и как используется человеком? 29. Что такое вакуоли? Как они образуются и каково их строение? 30. Что такое клеточный сок? 31. Как называются продукты вторичного обмена? Какие вещества к ним относятся? 32. Какова роль эргастических веществ в жизни растений? 33. Перечислите пигменты клеточного сока. Назовите пластидные пигменты 34. Какие вещества клеточного сока выпадают в виде кристаллов? Какие формы кристаллов вы знаете? 35. Что такое запасные питательные вещества и какова их роль в жизни растений? 36. Какие вещества откладываются в клетках в качестве запасных? 37. В каких органах растений локализуются запасные питательные вещества, в каких клеточных структурах? 38. Что такое алейроновое зерно? 39. Каковы методы обнаружения в растении белков, жиров и углеводов? 40. Как использует человек запасные питательные вещества растений? 41. Какова физиологическая роль следующих веществ клеточного сока сахаров, дубильных веществ, алкалоидов? 42. Какие типы деления клеток вы знаете? 43. Чем отличается амитоз от остальных делений? 44. В чем биологический смысл митоза? Мейоза? 45. Что такое митотический цикл клетки? 46. Как работает ядро в интерфазе? Из каких периодов состоит интерфаза? 47. Назовите и охарактеризуйте фазы митоза? Какова сравнительная продолжительность фаз? Меристематические ткани Основные понятия. Меристематические, или об разовательные ткани (меристемы) состоят из недифференцированных клеток, делящихся митотически. Образовательные ткани бывают первичными и вторичными. Зародыш семени состоит из первичной меристемы; этот тип меристемы сохраняется под корневым чехликом корня и в конусе нарастания (верхушке, апексе) побега. На конусе нарастания побега, немного ниже его вершины, закладываются бугорки – зачатки листьев (примордиальные листья). По мере удаления от апекса они становятся крупнее, в их пазухах появляются бугорки боковых пазушных почек. Развившиеся из листовых бугорков листовые примордии прикрывают вершину конуса нарастания. Ткань конуса нарастания растений широко используется в биотехнологии для получения оздоровлённого (свободного от вирусной инфекции) посадочного материала, а также для вегетативного размножения гибридных сортов полевых, плодово-ягодных и декоративных культур (картофель, земляника, малина, гвоздика, гладиолус и др.). Вторичные меристемы развиваются из первичных или из постоянных тканей. По положению в растении меристемы делят на верхушечные, боковые и вставочные. На месте травмированных органов возникают раневые меристемы. Работа 15 Первичная меристема верхушки побега элодеи канадской - Elodéa canadénsis Michx.
Порядок работы: Готовый препарат продольного разреза верхушки побега водного растения элодеи канадской рассматривают при малом увеличении. Находят конус нарастания, зачатки листьев (листовые бугорки). В пазухах листовых зачатков обнаруживают зачатки почек. Рассматривают клетки меристемы при большом увеличении. Обращают внимание на крупные ядра, густую цитоплазму, тонкие и прозрачные стенки. Схематично зарисовывают контуры среза, обозначают конус нарастания, зачатки листьев и пазушных почек, листья (рис. 12).
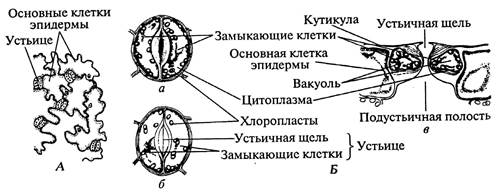
Рис. 12. Верхушка побега элодеи канадской - Elod é a canad é nsis Michx.: А – продольный разрез побега; Б – общий вид конуса нарастания; В – конус нарастания на разрезе Покровные ткани Основные понятия. Покровные ткани предохраняют органы растений от высыхания, а также от резких колебаний температуры и других неблагоприятных условий внешней среды. Различают первичные покровные ткани - эпидерму и эпиблему, и вторичную покровную ткань - пробку (феллему). Пробка входит в состав покровных комплексов - перидермы и корки. Газообмен и транспирация осуществляются в эпидерме через устьица, в перидерме и пробке - через чечевички. Основные ткани составляют большую часть тела растения и выполняют разнообразные функции. Их клетки имеют паренхимную форму, целлюлозные стенки, живой протопласт. Среди основных тканей различают паренхиму: ассимиляционную, основную, запасающую, поглощающую и воздухоносную. Основные ткани будут рассмотрены при изучении органов растений.
Работа 16 Эпидерма листа
Порядок работы: А. Вид с поверхности. Для изготовления временного препарата иголкой или пинцетом срывают эпидерму с нижней стороны листа гороха, ириса или другого растения. Помещают её на предметное стекло в каплю воды и накрывают покровным стеклом. При малом увеличении рассматривают эпидерму. Находят устьица: замыкающие клетки с хлоропластами и устьичную щель. При большом увеличении изучают структуру замыкающих клеток. Отмечают неравномерно утолщённые клеточные стенки: стенка, обращённая к щели, значительно толще противоположной. На свету при осмотическом поступлении воды в клетки, объем вакуолей в них увеличивается, более тонкие клеточные стенки растягиваются, прогибаются в сторону основных клеток эпидермы и увлекают за собой толстые части клеточной стенки – между замыкающими клетками образуется устьичная щель. 4. Зарисовывают устьице с прилегающими к нему основными клетками эпидермы (рис. 13 А). Б. Вид на поперечном разрезе. 1. На постоянном препарате поперечного разреза листа гороха, ириса или другого растения при малом увеличении находят устьица. 2. При большом увеличении рассматривают особенности основных клеток эпидермы (сильно утолщённые целлюлозные наружные стенки с кутикулой, вакуоли, отсутствие хлоропластов) и устьица. В полупогружённых замыкающих клетках устьица отмечают неравномерно утолщённые стенки (их тонкие участки примыкают к основным клеткам) и наличие хлоропластов. Под устьичной щелью хорошо заметен большой межклетник, дыхательная или подустьичная полость, которая облегчает газообмен через устьице. 3. Рассматривают основную хлорофиллоносную ткань (хлоренхима или мезофилл) листа, расположенную под эпидермой. 4. Зарисовывают эпидерму и два - три слоя клеток мезофилла (рис. 13 Б).
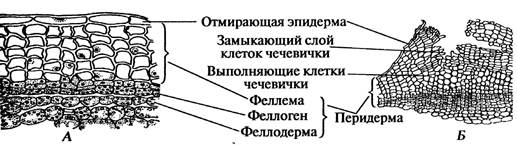
А. Перидерма Порядок работы: На ветках бузины кистевидной, или красной (Samb ú cus racem ó sa L.), смородины чёрной (R í bes n í grum L.), лещины обыкновенной, или Орешника (C ó rylus avell á na L.) или других растений рассматривают перидерму и находят чечевички. На постоянном препарате поперечного среза ветки бузины при малом увеличении изучают перидерму и чечевички. Ткани окрашены специальными красителями в разные цвета. При большом увеличении изучают строение перидермы. Снаружи располагаются шесть - восемь и более слоев феллемы коричневого цвета. Под ним лежит один слой феллогена. Его клетки окрашены в зеленовато-синеватый цвет. Под феллогеном видны один - два слоя более крупных клеток такой же окраски. Это феллодерма. Зарисовывают участок перидермы. Во время изучения перидермы при большом увеличении отмечают и отражают в рисунке особенность расположения радиальных стенок её клеток (радиальными называют стенки, расположенные в направлении радиуса органа). Радиальные стенки всех слоёв перидермы совпадают, т.е. служат как бы продолжением одна другой. Подписывают названия всех тканей (рис. 15 А). Рассмотреть и зарисовать чечевичку. Обратить внимание на округлую форму тонкостенных клеток с хорошо развитой системой межклетников. Выделить плотно сомкнутые клетки замыкающего слоя (рис. 15 Б).
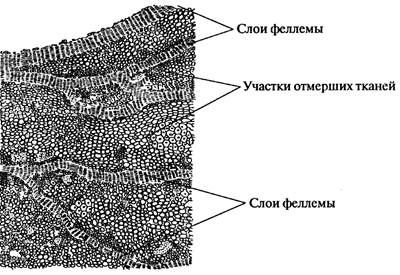
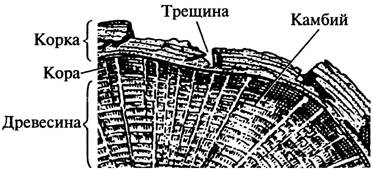
Рис. 15. Поперечный срез перидермы бузины кистевидной, или красной – Samb ú cus racem ó sa L.: А - участок перидермы; Б - чечевичка Б. Корка Рассматривают строение корки на спилах стволов дуба черешчатого - Qu é rcus r ó bur L. (рис. 16) и сосны обыкновенной - P í nus sylv é stris L. (рис. 17)В корке отмечают слоистость: светло-серые тонкие полоски феллемы чередуются с тёмно-окрашенными участками отмерших тканей. Корка пронизана глубокими трещинами. Схематично зарисовывают участок корки.
Рис. 16. Поперечный срез корки дуба черешчатого - Qu é rcus r ó bur L.
Рис. 17. Поперечный срез корки сосны обыкновенной - P í nus sylv é stris L. Проводящие пучки В органах растений ксилема и флоэма располагаются совместно, образуя проводящие пучки. Если между ксилемой и флоэмой есть камбий - пучки открытые, если камбия нет - закрытые. Открытые пучки характерны для двудольных покрытосемянных и голосемянных растений, закрытые - для однодольных покрытосемянных и папоротникообразных. В состав пучков нередко входит механическая ткань - склеренхима. Такие пучки называют сосудисто-волокнистыми. Ксилема и флоэма в закрытых пучках по происхождению первичны, т.к. формируются из прокамбия. В открытых пучках значительная часть ксилемы и флоэмы возникает в результате деятельности камбия, т.е. они вторичны происхождение, поэтому в составе открытых пучков есть первичная и вторичная ксилема, а также первичная и вторичная флоэма. По взаимному расположению ксилемы и флоэмы, проводящие пучки подразделяются на коллатеральные, биколлатеральные, концентрические и радиальные (рис. 23).
Рис. 23. Схема строения разных типов проводящих пучков: 1 – коллатеральный закрытый; 2 – коллатеральный открытый; 3 – биколлатеральный открытый; 4 – амфивазальный концентрический закрытый, 5 – амфикрибральный концентрический закрытый; 6 – радиальный тетрархный пучок
Работа 23 Закрытый коллатеральный пучок на поперечном срезе стебля кукурузы обыкновенной - Zéa máys L.
Порядок работы: При малом увеличении на постоянном препарате поперечного среза стебля кукурузы выбирают наиболее крупный пучок (ближе к центру среза). При большом увеличении рассматривают пучок. Отмечают, что ксилема и флоэма в нём окружены склеренхимой - сосудисто-волокнистый пучок. На препарате одревесневшие элементы ксилемы и склеренхима окрашены в красный цвет. Под склеренхимой, примыкая друг к другу, располагаются первичная ксилема (обращена к центру стебля) и первичная флоэма, (обращена к периферии стебля). В ксилеме хорошо заметны одревесневшие красные сосуды, а также водоносная полость. Всего на срезе видно три-пять сосудов, два из них наиболее крупные. Это пористые сосуды. В окрашенной голубым цветом флоэме видны ситовидные трубк
|
||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 535; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.107.152 (0.013 с.) |


 Б. Из клеток эндосперма
Б. Из клеток эндосперма