
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 1. Агрегатные состояния вещества. Фазовые равновесия. Фазовые переходы. Правило фаз.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
УДК 54
Макарова Т.П., Будкевич Р.Л. М 15 Физическая и коллоидная химия: Методические указания по выполнению контрольной работы по дисциплине «Физическая и коллоидная химия» для бакалавров направления 131000 «Нефтегазовое дело» заочной формы обучения. – Альметьевск: Альметьевский государственный нефтяной институт, 2014. – 68 с.
Методические указания предназначены для выполнения контрольной работы, подготовки к сдаче зачёта по дисциплине «Физическая и коллоидная химия» и полностью соответствуют программе курса для технических направлений и специальностей вуза.
В методических указаниях приведены: примеры решения задач; задачи для самостоятельного решения; список рекомендованной литературы (основной и дополнительный). Необходимый справочный материал для расчётов приведён в соответствующих приложениях, ссылка на которые даётся в методических указаниях по их выполнению.
Печатается по решению учебно-методического совета АГНИ.
Рецензенты:
Марданова Э.И. – к.т.н., доцент, зав. кафедрой прикладной химии АГНИ
Вахитова Р.И. – к.т.н, доцент, кафедры промышленной теплоэнергетики АГНИ
© Альметьевский государственный
Содержание Общие указания …………………………………………………………………….4
Варианты контрольных заданий …………………..……………………………5
Тема 1. Агрегатные состояния вещества. Фазовые равновесия. Фазовые переходы. Правило фаз. 1.1. Фазовые равновесия. Правило фаз…………………………………...................6 1.2. Диаграммы состояний…………………………………………………...……...8 1.3. Перегонка. Состав смеси……………………………………………....……..12 1.4. Закон распределения. Экстракция…………………………………… ……..15
Тема 2. Растворы – физико-химические системы. 2.1. Растворимость………………………………………………………...……..…18 2.2. Энергетика растворения…………………………………………………….…20 2.3. Осмотическое давление разбавленных растворов неэлектролитов………………………………………………………………….…..23 2.4. Давление пара разбавленных растворов неэлектролитов. Первый закон Рауля…………………………………………………………….…...25 2.5. Температура замерзания и кипения растворов неэлектролитов.
Второй закон Рауля……………………………………………………………….....27 2.6. Растворы сильных электролитов………………………………………….…..29 2.7. Буферные растворы. Буферная ёмкость……………………………….……...32 2.8. Потенциометрическое и кондуктометрическое титрование…………….…..38 Тема 3. Дисперсные системы. Оптические и электрокинетические свойства. Строение мицелл. ККМ в растворах ………………………………….…....42 Тема 4. Поверхностные явления. Сорбция. Классификация сорбционных явлений. Механизмы процессов сорбции …...………….……………….….….46 Тема 5. Устойчивость коллоидных растворов. Коагуляция. Седиментация ….……………………...……………………………………………………......55 Тема 6. Лиофобные дисперсные системы ……………………………………..62 Тема 7. Лиофильные дисперсные системы ……………………………………64 Приложение ………………………………………………………………………..66 Образец заполнения титульного листа ……………………………………….67 Список литературы.................................................................................................68 ОБЩИЕ УКАЗАНИЯ Настоящие методические указания предназначены для выполнения контрольной работы, подготовки к сдаче зачёта по дисциплине «Физическая и коллоидная химия». Содержание и объём требований определяется программой дисциплины «Физическая и коллоидная химия».
При оформлении контрольной работы следует придерживаться следующих правил: - все задачи должны строго соответствовать варианту; - условия задач должны быть переписаны в тетрадь полностью; - решения задач должны содержать краткие объяснения и комментарии к выполненным арифметическим действиям, ссылки на использованные при решении законы и правила; - необходимо пользоваться современной научной химической номенклатурой; - все величины должны быть выражены в единицах международной системы (СИ); - на каждой странице необходимо оставлять поля для замечаний рецензента; - каждая задача записывается с новой страницы. - построение графиков, предусмотренное при решении задач, должно быть осуществлено на миллиметровой бумаге. При определении варианта контрольной работы студенту необходимо обратить внимание на свой шифр (номер личного дела). Номер варианта соответствует двум последним цифрам номера личного дела (зачетной книжки, студенческого билета).
Прежде чем приступать к решению той или иной задачи, следует изучить теоретические основы данного раздела и усвоить тот объем теоретического материала, который необходим для осознанного решения задачи. Полезно ознакомиться с решениями типовых задач и примеров, приведенными в пособии. Выполненную контрольную работу следует направить на кафедру прикладной химии. Получив проверенную работу, в случае необходимости нужно исправить допущенные ошибки в той же тетради и сдать её на повторное рецензирование.
Варианты контрольных заданий
Диаграммы состояний
Пример 1. Золото Au и платина Pt в твёрдом состоянии образуют непрерывный ряд твёрдых растворов и смешиваются в жидком состоянии во всех соотношениях. Используя диаграмму состояния этих сплавов (рис.1.1): 1. построить кривую охлаждения сплава, состоящего из 40% золота Au и 60% платины Pt; 2. определить при 1400°С состав и количественное соотношение жидкой и твёрдой фаз для сплава, содержащего равные количества обоих компонентов.
состояния Au - Pt
Решение: 1. Для построения кривой охлаждения определим, через какие области диаграммы пройдет точка а. Выше линии АМВ точка движется в гомогенной области жидкого расплава. При достижении линии АМВ из жидкого расплава начинают выпадать кристаллы твёрдого раствора. В связи с этим составы жидкой и твёрдой фаз изменяются. Состав твёрдой фазы по мере понижения температуры изменяется по линии солидуса (линия АNВ), а состав жидкой фазы – по линии ликвидуса (линия АМВ). На кривой охлаждения наблюдаются два перегиба: в точке пересечения с линией ликвидуса и в точке пересечения с линией солидуса. 2. Для определения количественного соотношения твёрдой и жидкой фаз применимо правило рычага. Для этого от точки О (точка пересечения перпендикуляра, восстановленного из точки на оси концентраций, соответствующей сплаву из 50% платины и 50% золота, и прямой, проходящей через 1400°С) измеряем длину отрезков ОN и ОМ; соотношении их длин соответствует количественному соотношению интересующих нас фаз.
Допустим, что длина отрезка ОN равна 15 мм, а длина отрезка ОМ – 10мм. Тогда соотношение жидкой и твёрдой фаз составит 10: 15. Зная количество сплава, можно рассчитать и количество каждой фазы. Предположим, что вес сплава 5 кг. Это количество будет пропорционально всей длине линии МN, т.е. 10 + 15 = 25мм. Тогда количество твёрдой фазы будет равно 15: 25 = Х: 5, откуда Х = 3 кг. Состав определяется, если из конечных точек прямой МN опустить перпендикуляры на ось концентраций. Перпендикуляр, опущенный из точки М на ось концентраций, определяет состав жидкой фазы, а перпендикуляр, опущенный из точки N, дает состав твёрдой фазы. В нашем случае состав твёрдой фазы содержит около 65% платины Pt, а состав жидкой фазы – 30 % платины Pt. Задачи для самостоятельного решения
26. Эвтектика сплава Ag – Сu (рис. 1.2) имеет состав: 28% Сu и 72% Ag. Какая масса эвтектики содержится в 750 г твёрдого сплава, если сплав содержит 63% Сu и 37% Ag? Рис. 1.2 27. По диаграмме плавкости (рис. 1.2) найдите состав жидкой и твёрдой фаз в системе, содержащей 85% Ag и 15% Сu при 930 °С. Какая масса твёрдой фазы выделится из 2,3 кг сплава при этой температуре? 28. По диаграмме плавкости (рис. 1.2) найдите состав жидкой и твёрдой фаз в системе, содержащей 30% Ag и 70% Сu при 950 °С. Какая масса твёрдой фазы выделится из 10,5 кг сплава при этой температуре? 29. По диаграмме плавкости (рис. 1.2) найдите состав жидкой и твёрдой фаз в системе, содержащей 50% Ag и 50% Сu при 900 °С. Какая масса твёрдой фазы выделится из 1,5 кг сплава при этой температуре? 30. Сколькими степенями свободы обладает система, 33. При какой температуре будет затвердевать и плавиться сплав, содержащий 80% Аu и 20% Pt? Определите число степеней свободы для сплава данного состава при 1200°С (рис. 1.3). 34. При какой температуре будет затвердевать и плавиться сплав, содержащий 20% Аu и 80% Pt? Определите число степеней свободы для сплава данного состава при 1200°С (рис. 1.3). 35. По диаграмме плавкости системы Mg – Zn (рис. 1.4) определите формулу интерметаллического соединения, образуемого этими металлами. Какова масса химического соединения, содержащегося в 250 г сплава состава: 40% Zn и 60% Mg?
Рис. 1.3 Рис. 1.14
36. Определить с помощью диаграммы (рис.1.5) сколько хлорида калия KCl нужно прибавить к 2,5 кг хлорида лития LiCl, чтобы понизить температуру его затвердевания до 500°С. 37. Определите с помощью диаграммы (рис.1.5) сколько хлорида калия КCl выделится из 6500 г 80%-ного (по КCl) расплава при охлаждении до 600, 500, 400 и 361°С, 38. Определите с помощью диаграммы (рис. 1.5) сколько останется жидкости если охладить 1250 г 35 %-ного расплава до 450°С. 39. Определите с помощью диаграммы (рис.1.5) сколько хлорида калия KCl нужно прибавить к 4,8 кг хлорида лития LiCl, чтобы понизить температуру его затвердевания до 450°С. 40. Определите с помощью диаграммы (рис.1.5) сколько нужно прибавить хлорида лития LiCl к 1,8 кг хлорида калия KCl, чтобы понизить температуру его затвердевания до 550°С. 41. Определите с помощью диаграммы (рис.1.5) сколько нужно прибавить хлорида лития LiCl к 5,5 кг хлорида калия KCl, чтобы понизить температуру его затвердевания до 450°С.
42. На диаграмме (рис. 1.6), обозначьте следующие состояния системы висмут – кадмий Bi – Cd: точка А – чистый твёрдый висмут Bi в равновесии с жидким висмутом Bi; точка Б – чистый твёрдый кадмий Cd в равновесии с жидким кадмием Cd; точка В – жидкий сплав при 200°, содержащий 20 % кадмия Cd; точка Г – сплав, содержащий 15 % кадмия Cd в равновесии с кристаллами висмута Bi; точка Д – систему, состоящую из равных количеств твёрдого кадмия Cd и жидкого сплава, содержащего 75 % кадмия Cd; точка Е – жидкий сплав в равновесии с твёрдым кадмием Cd и висмутом Bi. 43. Определите с помощью диаграммы (рис. 1.6), сколько кадмия Cd выделяется из 350г 55%-ного расплава при охлаждении его до 150°С. 44. Определите с помощью диаграммы (рис. 1.6), сколько кадмия Cd выделяется из 1300г 65%-ного расплава при охлаждении его до 150°С. 45. Определите с помощью диаграммы (рис. 1.6), сколько кадмия Cd выделяется из 600г 75%-ного расплава при охлаждении его до 150°С. 46. Определите с помощью диаграммы (рис. 1.6), сколько кадмия Cd выделяется из 800г 80%-ного расплава при охлаждении его до 200°С. 48. Определите с помощью диаграммы(рис. 1.6), сколько кадмия Cd выделится из 1,5 кг 90 %-ного сплава, если его охладить до 350, 250 и 144°. 47. Определите с помощью диаграммы (рис. 1.6), сколько эвтектики получится из 1,5 кг сплава, содержащего 85 % кадмия Cd. 49. Определите с помощью диаграммы (рис. 1.6), сколько висмута Bi нужно прибавить к 150 г 70 %-ного сплава, охлажденного до 200°С чтобы выпавший кадмий Cd растворился. 50. Из скольких фаз состоит сплав, содержащий 20% Bi и80 % Cd при 250ºС? Сколькими степенями свободы обладает эта система (рис. 1.6)?
Перегонка. Состав смеси Пример 1. Рассчитайте, в каком весовом соотношении будут перегоняться вода и бромбензол, если при 95,25°С давление паров бромбензола равно 121 мм рт.ст., а воды – 639 мм рт.ст. Жидкости взаимонерастворимы. Решение: Молекулярная масса воды равна 18 г/моль, а бромбензола – 157г/моль. Для решения используем уравнение: Т. о., отношение веса бромбензола к весу воды в дистилляте будут составлять 1,65. Т.е. на 100 кг перегнанной воды будет приходиться 165 кг бромбензола. Соотношение числа молей этих веществ составит 121: 639 = 1: 5, т.е. с 1 молем бромбензола будет перегоняться 5 молей воды.
Пример 2. Задача. Две жидкости А и В неограниченно растворимы друг в друге. Давление пара этой смеси при 150°С представляет линейную функцию от концентрации. Давление пара компонента А при этой температуре равно 800 мм рт.ст., а компонента В – 500 мм рт.ст. Вычислите отношение числа молей компонента А к числу молей компонента В в парах над смесью содержащей 5 мол.% компонента А. Определите состав смеси, кипящей при температуре 150°С под давлением 760 мм рт.ст. Решение: а) для определения соотношения компонентов А и В в паровой фазе найдём значения парциальных давлений этих компонентов над смесью, состоящей из 95 мол.% вещества В и 5 мол.% вещества А.
Подставив Ха = 0,05, Ра = 800 мм рт.ст и Рв = 500 мм рт.ст. получим: Ра = 0,005 × 800 = 40 мм.рт.ст. Рв = 0,95 × 500 = 495 мм рт.ст. Соотношение числа молей компонентов в паровой фазе равно соотношению парциальных давлений этих компонентов.
Т.о. при температуре 150°С над жидкой смесью, состоящей из 95 мол.% вещества В и 5 мол.% вещества А, в паровой фазе на 100 молей вещества В приходится 8 молей вещества А. Общее давление пара над смесью сумме парциальных давлений компонентов: 40 + 495 = 535 мм рт.ст. б) мольную долю вещества А в смеси, кипящей под давлением 760мм рт.ст. определяем по уравнению: Р = Ха(Ра – Рв) + Рв, 760 = Ха (800 – 500) + 500,
Следовательно, смесь, кипящая при температуре 150°С и давлении 760 мм рт.ст. содержит 0,87 мольных долей компонента (87 мол.%) А и 0,13 мольных долей (13 мол.%) компонента В. Задачи для самостоятельного решения 51. Камфара и вода нерастворимы друг в друге. Сколько следует отогнать водяного пара, чтобы получить в дистилляте 30 г камфары. Смесь воды и камфары кипит при 99°С и давлении 760 мм рт.ст. Молекулярный вес камфары равен 152. Давление паров воды составляет 733 мм рт.ст. при 99°С? 52. Нитробензол и воданерастворимы друг в друге. Рассчитайте,какое количество нитробензола отгонится с водяным паром при перегонке данной смеси, если общее количество дистиллята составляет 20 кг. Смесь начинает кипеть при температуре 99°С и давлении 760 мм рт.ст. Давление паров воды равно при этой температуре 733 мм рт.ст., а нитробензола – 27мм рт.ст. 53. При 50°С давление пара чистого дихлорэтана равно 236,2 мм рт.ст., а бензола – 268 мм рт.ст. Бензол и дихлорэтан взаиморастворимы. Давление пара смеси бензола и дихлорэтана в зависимости от концентрации выражается прямой линией. Определить состав жидкости (масс. %), при условии, что парциальные давления компонентов равны между собой. 54. Жидкая смесь содержит 25% бензола. Толуол имеет давление паров 290мм рт.ст., а бензол – 753 мм рт.ст. при 80°С. Каков весовой состав паров смеси этих веществ (масс. %)? 55. Давление паров чистого толуола равно 36,7 а бензола – 120,2 мм рт.ст. при 30 °С. Жидкость содержит эти компоненты в эквимолярных количествах. Какой состав (масс. %) имеет парообразная фаза. 56. При 250,9 мм рт.ст. и 70°С жидкость, несмешивающаяся с водой, перегоняется с водяным паром. Вода при этой температуре имеет давление паров 233,7 мм рт.ст. Полученный дистиллят содержит 18,82 масс. % жидкости. Вычислить молекулярный вес этой жидкости. 57. Температура кипения азотной кислоты 86 °С. Температура кипения чистой воды 100°С. Азотная кислота и вода образуют азеотропную смесь, содержащую 68 % кислоты и 32% воды. Температура кипения азеотропной смеси 120,5°С. Определите, что останется в остатке, и какой компонент будет преимущественно отгоняться при перегонке смесей содержащих: а) 82% кислоты и 18% воды; б) 55% кислоты и 45% воды? 58. Температура кипения хлористого водорода 85°С. Температура кипения чистой воды 100°С. Хлористый водород и вода образуют азеотропную смесь, состоящую из 20,24% хлористого водорода и 79,76% воды. Температура кипения азеотропной смеси 108,5°С. Определите, что станется в остатке, и какой компонент будет отгоняться, если подвергнуть перегонке смеси, содержащие: а) 12% хлористого водорода и 88% воды; б) 55% хлористого водорода и 45% воды? 59. Температура кипения этилового спирта 78,3°С, а воды – 100°С. Этиловый спирт и вода образуют азеотропную смесь состоящую из 4,43 % воды и 95,57% спирта. Температура кипения азеотропной смеси 78,13°С. Определите, что останется в остатке, и что будет отгоняться при дистилляции смесей, содержащих: а) 72% воды и 38% спирта; б) 3% воды и 97% спирта? 60. Температура кипения пиридина равна 115°С. Температура кипения воды равна 100°С. Вода и пиридин образуют азеотропную смесь, содержащую 41% воды и 59% пиридина. Температура кипения азеотропной 92°С. Определите, что будет перегоняться и что останется в остатке при дистилляции смесей, содержащих: а) 75% воды и 25% пиридина; б) воды 75% и пиридина 25%? 61. Температура кипения метилового спирта 65°С, а ацетона – 56°С. Эти вещества образуют азеотропную смесь, содержащую 86,5 % ацетона. Температура кипения азеотропной смеси 55,95°С. Определите, что будет перегоняться и что останется в остатках при дистилляции смесей, содержащих: а) 78% спирта и 22% ацетона; б) 6% спирта и 94% ацетона?
Растворимость Пример 1. Определение растворимости вещества. Вычислите растворимость BaCI2 в воде при 0ºС, если при этой температуре в 13,1 г раствора содержится 3,1 г BaCI2. Решение. Растворимость (или коэффициент растворимости) выражают массой вещества (г), которое можно растворить в 100 г растворителя при данной температуре. Масса раствора BaCI2 13,1 г. Следовательно, масса растворителя 10 г. Т.о. растворимость BaCI2 при 0 ºС равна 100·3,1/10 = 31 г. Пример 2. Определение массы растворенного вещества, выделяющегося при кристаллизации раствора. Растворимость AlCI3 при 0ºС равна 44,9 г, а при 80ºС – 48,6 г. Какова масса соли, выпадающей в осадок, если при 540,0 г раствора хлорида алюминия охладить от 80 до 0ºС? Решение. Масса раствора AlCI3 равна: а) при 80ºС 100 + 48,6 = 148,6 г; б) при 0ºС 100 + 44,9 = 144,9 г. При охлаждении 148,6 г раствора хлорида алюминия в осадок выпадает 148,6 – 144,9 = 3,7 г AlCI3. Если охладить 540 г раствора AlCI3, то в осадок выпадает: x = Пример 3. Определение массы газа в растворе по его растворимости. Сколько хлороводорода растворится в 100 л воды при 40ºС и давлении 98625 Па, если растворимость HCI при этой температуре (и давлении 1,0133×105 Па) составляет 386 м3 на 1 м3 воды? Решение. Определяем объём HCI, содержащегося в 100 л воды при 40ºС и давлении 1,0133×105 Па: 1000 л H2O — 386 м3 100 л H2O — х м3 х = Массу HCI вычисляем по уравнению Менделеева – Клайперона; М (HCI) = 36,46 г/моль. Тогда: m = Пример 4. Определение состава газовой смеси по растворимости газов. Газовая смесь, содержащая 21% O2 и 79% N2, пропущена через воду при 0ºС и давлении 1,0133×105 Па. Вычислите объёмные доли φ газовой смеси, растворённой в воде, если растворимость кислорода и азота в воде при этой температуре и давлении соответственно равна 0,049 и 0,0236 м3 на 1 м3 воды. Решение. Согласно закону Генри растворимость (Р) газа в воде пропорциональна его парциальному давлению в смеси. Определим парциальное давление газов в смеси: p О2 = 1,0133 × 105 × 0,21 = 0,2128 × 105 Па; p Учитывая парциальные давления, определяем растворимость газов: Р Р Общий объём азота и кислорода; 0,0104 + 0,0189 = 0,0293 м3. Тогда объёмная доля газов и смеси составит (%): φ Задачи для самостоятельного решения
81. При 100ºС коэффициент растворимости хлорида кальция CaCl2 в воде равен 158 г на 100 г воды. Расчитайте, какая масса хлорида кальция при этой температуре содержится в 1,35 кг раствора соли? Ответ: 827,8 г 82. При 0ºС 50 г раствора содержат 3,44 г сульфата калия K2SO4. Вычислит массовую долю соли и его коэффициент растворимости при данных условиях. Ответ: 6,88%; 7,40 г. 83. 500 г раствора хлорида кобальта при 20ºС содержат 173 г соли. Определите массовую долю CоCl2 и растворимость. Ответ: 34,6%; 52,7 г. 84. Какая масса сульфата меди выпадет в осадок, если охладить 825 г раствора от 100 до 20ºС, если растворимость CuSO4 при 20 ºС и 100 ºС равна соответственно 20,2 и 77г? Ответ: 264,7 г. 85. В 100 г растворителя при 100ºС содержится 155 г соли K2СO3, а при 0ºС 111 г. Определите массу карбоната калия, выпавшего в осадок из 770 г насыщенного при 100ºС раствора и охлаждённого до 0ºС. Ответ: 132,9 г 86. Растворимость соли при 90ºС и 25ºС соответственно составляет 42,7 и 6,9г. Какую массу воды и соли надо взять, если при охлаждении насыщенного при 90ºС раствора до 25ºС выкристаллизовалось 200 г соли? Ответ: 558,7 г; 238,5 г 87. Какова масса диоксида углерода, содержащегося в 25 л Н2О, при 0ºС и давлении 0,745×105 Па, если растворимость СО2 в воде при этой температуре и давлении 1,0133×105Па равна 1,713 м3 на 1 м3 воды? Ответ: 62 г. 88. Растворимость хлора при 10ºС и давлении 1,0133×105 Па составляет 3,148 м3 на 1м3 воды. Какой объём воды надо взять, чтобы растворить 250 г хлора при 10ºС и давлении 1,5×105Па? Ответ: 17,5 л. 89. Растворимость сероводорода при 20 ºС и давлении 1,0133×105 Па равна 2,91 л на 1 л воды. Вычислите массовую долю Н2S в полученном растворе. Ответ: 0,4 % 90. Под каким давлением должен находиться диоксид углерода, чтобы при растворении его в воде получили раствор с массовой долей СО2 1%? Коэффициент абсорбции СО2 при 20 ºС равен 0,878. Ответ: 6,37×105 Па 91. Определите массовую долю HCI в растворе, полученном при растворении 4,9 л хлороводорода в 0,05 л воды при 18ºС и давлении 1,0×105 Па. Ответ: 12,87 % 92. Каково массовая доля (%) водорода в растворе при 30ºС и давлении 965000 Па, если коэффициент абсорбции водорода водой при 30ºС составляет 0,017? Ответ: 0,13 % 93. Газовая смесь, состоящая из водорода и оксида углерода (IV), растворена в воде при 10ºС и давлении 1,0133×105 Па. Определите объёмные доли Н2 и СО2 в газовой смеси, растворённой в воде, если коэффициенты абсорбции Н2 и СО2 соответственно равны 0,0199 и 1,194. Ответ: 1,09; 98,91 % 94. В воде при 20ºС и общем давлении 2,5×105 Па растворена газовая смесь, состоящая из О2, N2 и Cl2. Объёмные доли этих газов в смеси соответственно равны 15, 25 и 60 %. Растворимость газов в 1 м3 воды (м3): РО2 = 0,031; РN2 = 0,016; РCl2 = 2,299. Определите объёмные доли газов в газовой смеси, растворённой в воде. Ответ: 0,23; 0,27, 99,5 %
Энергетика растворения Пример 1. Определение теплоты растворения вещества. При растворении 8 г хлорида аммония в 29 г воды температура понизилась на 2ºС. Вычислите теплоту растворения NH4CI в воде, принимая удельную теплоёмкость полученного раствора равной теплоёмкости воды 4,1870Дж/(г·К). Решение: Теплота растворения Δ H раств – количество теплоты, поглощающейся (или выделяющейся) при растворении 1 моль вещества в таком объёме растворителя, дальнейшее прибавление которого не вызывает изменения теплового эффекта. Теплота растворения имеет отрицательные значения, если при растворении теплота поглощается, и положительные, если теплота выделяется. Количество теплоты, выделяемое при нагревании или охлаждении тела, равно: Q = cm Δ T, где с – удельная теплоёмкость вещества, Дж/ (г·К); m – масса вещества, г; Δ T – изменение температуры. При растворении 8 г NH4CI в 291 г воды поглощается следующее количество теплоты: Q = 4,187 · 291 (–2) = –2435,1 Дж. Для определения теплоты растворения NH4CI составляем пропорцию, M (NH4CI) = 53,49 г /моль: 8 г NH4CI – (–2435,1) Дж 53,49 г NH4CI – x Дж X = Следовательно, Δ H раств = –16,3 кДж/моль. Пример 2. Определение теплоты гидратации вещества. При растворении 52,06 г BaCI2 в 400 моль H2O выделяется 2,16кДж теплоты, а при растворении 1 моль BaCI2×2H2O в 400 моль H2O поглощается 18,49 кДж теплоты. Вычислите теплоту гидратации безводного BaCI2. Решение: Теплота гидратации Δ H ºгидр – теплота, выделяемая при взаимодействии 1 моль растворяемого вещества с растворителем – водой. Процесс растворения безводного BaCI2 можно представить следующим образом: а) гидратация безводной соли BaCI2 BaCI2 + 2H2O = BaCI2×2H2O + Δ H ºгидр б) растворение образовавшегося гидрата BaCI2×2H2O+aq*→ BaCI2×2H2O(aq) + Δ H ºраст. Количество теплоты Δ H º, выделяющееся при растворении безводного BaCI2, равно алгебраической сумме тепловых эффектов этих двух процессов: Δ H º = Δ H ºгидр + Δ H ºраств; Δ H ºгидр = Δ H º – Δ H ºраств. Для вычисления теплоты гидратации безводного хлорида бария надо определить теплоту растворения BaCI2 для тех же условий, что и для BaCI2×2H2O, т.е. для 1 моль BaCI2 (раствор в обоих случаях должен иметь одинаковую концентрацию); M 52,06 г BaCI2 – 2,16 кДж 208,25 г BaCI2 – х кДж х = Следовательно, Δ H ºраств = 8,64 кДж/моль; Δ H ºгидр = 8,64 – (–18,49) = 27,13 кДж/моль. Пример 3. Вычисление теплового эффекта реакции растворения. Рассчитайте тепловой эффект реакции растворения алюминия в разбавленной соляной кислоте, если стандартные теплоты образования реагирующих веществ равны (кДж/моль): Δ H º Решение: Реакция растворения Al в соляной кислоте протекает по уравнению 2Al + 6HCI(aq) = 2AlCI3(aq) + 3H2. Тепловой эффект реакции растворения равен: Δ H º298 = 2Δ H º
Пример 4. Определение возможности протекания реакции растворения по значению энергии Гиббса. Будет ли растворятся сульфид меди в разбавленной серной кислоте, если энергия Гиббса реагирующих веществ равна (кДж/моль):
Δ G º CuS(к) = –48,95; Δ G º Δ G º Решение: Для ответа на вопрос задачи необходимо подсчитать Δ G º298 реакции. Реакция растворения CuS в разбавленной H2SO4 могла бы протекать по уравнению: CuS(к) + H2SO4(aq) = CuSO4(aq) + H2S(г) Δ G º298 = Δ G º = – 677,5 – 33,02 + 742,5 + 48,95 = + 80,97 кДж/моль. Так как Δ G º > 0, реакция невозможна, т.е. CuS не будет растворяться в разбавленной H2SO4.
Задачи для самостоятельного решения
95. В 545 г раствора нитрата бария при при 20ºС содержится 45 г соли. Вычислите растворимость Ba(NO3)2 в воде этой температуре. Ответ: 9 г. 96. Высчитайте теплоту растворения хлорида натрия NaCI, если при растворении в воде 23,38 г NaCI поглощается 2,14 кДж теплоты. Ответ: 5,35 кДж/моль 97. Какое количество теплоты выделится при растворении в воде 225 г гидроксида натрия NaOH, если теплота растворения NaOH в воде равна 41,6 кДж/моль? Ответ: –234 кДж 98. При растворении 25 г хлорида калия KCI в 1 л H2O температура понизилась на 1,5º. Вычислите теплоту растворения KCI в воде, если удельная теплоёмкость полученного раствора равна 4,18 кДж/(г·К). Ответ: 18,7 кДж 99. Какую массу нитрата аммония NH4NO3 надо растворить в 0,2 л воды, чтобы понизить температуру на 5º? Теплота растворения NH4NO3 равна –26,32 кДж/моль. Удельная теплоемкость полученного раствора равна 3,77 Дж/(г·К). Ответ: 11,46 г 100. На сколько градусов повысится температура, если в 250 мл воды растворить 6 г карбоната натрия Na2CO3? Теплота растворения Na2CO3 в воде равна 25,6 кДж/моль. Удельную теплоёмкость раствора принять равной 4,174 Дж/(г·К). Ответ: 1,38ºС 101. При растворении 4,0 г сульфата меди CuSO4 в 0,2 л воды температура повысилась на 2º. Вычислите теплоту гидратации CuSO4, если теплота растворения кристаллогидрата сульфата меди CuSO4×5H2O равна –11,72 кДж/моль. Удельная теплоёмкость раствора равна 4,18 Дж/(г·К). Ответ: –78,44 кДж/моль 102. При растворении 38,1 г кристаллогидрата сульфата магния MgSO4×6H2O в 7208 г H2O поглощается 70 Дж теплоты. Рассчитайте теплоту гидратации сульфата магния MgSO4, если теплота растворения 1 моль MgSO4 в 400 моль воды равна 84,94 кДж/моль. Ответ: –85,36 кДж/моль 103. Рассчитайте теплоту растворения безводного сульфита натрия Na2SO3 в воде, если при растворении 1 моль кристаллогидрата сульфита натрия Na2SO3×7H2O в 800 моль воды поглощается 46,86 кДж теплоты. Теплота гидратации Na2SO3 равна 58,16 кДж/моль. Ответ: –11,3 кДж/моль 104. На сколько градусов повысится температура при растворении 1 моль сульфата цинка ZnSO4 в 400 моль воды H2O, если теплота растворения 1 моль кристаллогидрата сульфата цинка ZnSO4×7H2O в 400 моль равна –17,70 кДж/моль? Теплота гидратации безводного сульфата цинка равна 95,27 кДж/моль. Теплоёмкость раствора равна 4,19 Дж/(г·К). Ответ: 2,56ºС 105. Определите теплоту гидратации гидрофосфата натрия Na2HPO4, если при растворении 14,2 г Na2HPO4 в 7208 г воды выделяется 2,36 кДж теплоты, а при растворении 35,8 г кристаллогидрата гидрофосфата натрия Na2HPO4×12H2O в том же количестве воды поглощается 9,51 кДж теплоты. Ответ: –118,7 кДж/моль 106. Определите тепловой эффект реакции растворения натрия Na в воде, если Δ H NaOH(aq) = –469,93 кДж/моль. Ответ: –368,2 кДж 1
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2019-05-20; просмотров: 451; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.175.189 (0.017 с.) |

 Рис. 1.1. Диаграмма
Рис. 1.1. Диаграмма

 Рис.1.5
Рис.1.5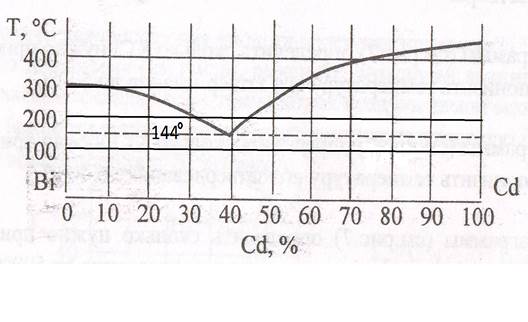 Рис. 1.6
Рис. 1.6



 1 – Ха = 1 – 0,87 = 0,13
1 – Ха = 1 – 0,87 = 0,13 = 13,4 г (AlCI3)
= 13,4 г (AlCI3) м3
м3 =
=  53,4 кг.
53,4 кг. = 1,0133 × 105 × 0,79 = 0,8005 × 105 Па.
= 1,0133 × 105 × 0,79 = 0,8005 × 105 Па.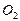 =
= 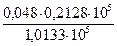 = 0,0104 м3;
= 0,0104 м3; = 0,0189 м3.
= 0,0189 м3. = –16,282 = –16,3 кДж.
= –16,282 = –16,3 кДж. = 208,25 г/моль:
= 208,25 г/моль: = 8,64 кДж.
= 8,64 кДж.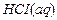 = –167,5;
= –167,5; 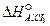 (aq) = – 672,3.
(aq) = – 672,3. – 6Δ H º
– 6Δ H º 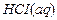 = 2(–672,3) – (–167,5)6 = –339,6 кДж.
= 2(–672,3) – (–167,5)6 = –339,6 кДж.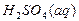 = –742,5;
= –742,5;  = –677,5, Δ G º
= –677,5, Δ G º 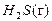 = –33,02.
= –33,02. =
=


