
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Растворы сильных электролитов
Пример 1. Вычисление изотонического коэффициента раствора сильного электролита по осмотическому давлению раствора. Осмотическое давление 0,1 н. сульфата цинка ZnSO4 при 0 ºС равно 1,59×105 Па. Вычислите изотонический коэффициент этого раствора. Решение. Изотонический коэффициент i показывает, во сколько раз значения осмотического давления р осм, повышения температуры кипения Δ t `кип (или понижения температуры замерзания Δ t `зам), понижения давления пара растворителя Δ р ` для раствора электролита, найденные экспериментально, больше соответствующих значений (Δ р осм, Δ t `кип,Δ t `зам, Δ р) для растворов неэлектролитов при той же молярной концентрации или молярности. Отклонение растворов электролитов от законов Вант-Гоффа и Рауля объясняется тем, что при растворении электролита в воде увеличивается общее число частиц, так как электролиты диссоциируют на ионы. Значение изотонического коэффициента для растворов электролитов больше 1, а для растворов неэлектролитов равно 1. Осмотическое давление для растворов электролитов с учетем изотонического коэффициента равно: р осм = i Пример 2. Вычисление изотонического коэффициента по давлению пара растворителя над раствором. Давление водяного пара над раствором 24,8 г хлорида калия KCI в 100 г воды H2O при 100ºС равно 9,14×104 Па. Вычислите изотонический коэффициент, если давление водяного пара при этой температуре равно 1,0133×105 Па. Решение. Первый закон Рауля для электролитов выражается уравнением:
M (KCI) = 74,56 г/моль; n = 24,8/74,56 = 0,33 моль; M (H2O) = 18,02 г/моль; N = 100/18,02 = 5,55 моль. Изотонический коэффициент равен: i =
Пример 3. Вычисление кажущейся степени диссоциации сильного электролита по значению изотонического коэффициента. Изотонический коэффициент 0,2 н. раствора нитрата кальция Ca(NO3)2 равен 2,48. Вычислите кажущуюся степень диссоциации этого электролита. Решение. В случае сильных электролитов кажущуюся степень диссоциации определяют экспериментально, она всегда меньше истинной степени диссоциации, которая близка к единице. Степень диссоциации и изотонический коэффициент электролита связаны между собой соотношением α =
где n – число ионов, образующихся при диссоциации молекулы вещества. При диссоциации Ca(NO3)2 образуется три иона. Кажущаяся степень диссоциации этого электролита равна α =
Пример 4. Вычисление степени диссоциации электролита по осмотическому давлению его раствора. Рассчитайте кажущуюся степень электролитической диссоциации хлорида лития LiCI в 0,1 н. растворе соли, если раствор изотоничен с 0,19 М раствором сахара C12H22O11 при 0ºС. Решение. Мольная масса сахара равна 342,3 г/моль. Осмотическое давление 0,19 М раствора сахара равно poc м = M (LiCI) = 42,39 г/моль. По осмотическому давлению определяем изотонический коэффициент раствора LiCI: i = Кажущаяся степень диссоциации в 0,1 н. LiCI равна α = Задачи для самостоятельного решения 157. Температура раствора сахара C12H22O11 50ºС, а плотность 1230 кг/м3. Найдите изотонический коэффициент 9×10-4 н. раствора нитрата калия KNO3, если этот раствор изотоничен с водным раствором сахара, в котором массовая доля C12H22O11 равна 50 %. Ответ: 2,0 158. Чему равен изотонический коэффициент раствора хлорида кальция CaCI2, если давление паров воды при 90ºС равно 70101 Па? Давление водяного пара над раствором 66,6 г CaCI2 в 90 г H2O при этой же температуре равно 56690 Па. Ответ: 1,78 159. Определите давление водяного пара над раствором бромида калия KBr при 50ºС, если давление паров воды при 50ºС равно 12334 Па и изотонический коэффициент раствора 178,5 г KBr в 900 г H2O равен 1,7. Ответ: 1,17×104 Па 160. Рассчитайте изотонический коэффициент раствора, который содержит 16,05 г нитрата бария Ba(NO3)2 в 500 воды и кипит при 100,122ºС. Ответ: 1,92 161. Вычислите температуру замерзания водного раствора соляной кислоты НCI (ω = 6,8 %), в котором изотонический коэффициент равен 1,66. Ответ: –6,15º
162. Сколько растворенных частиц содержится в 10-3 л раствора азотной кислоты HNO3, если изотонический коэффициент 1 н. раствора HNO3 равен 1,03? Ответ: 6,20×1020 163. Чему равен изотонический коэффициент раствора, полученного при растворении 0,1 моль плавиковой кислоты HF в 1 л воды, если 15 % растворенных молекул распалось на ионы? Ответ: 1,15 164. Вычислите изотонический коэффициент раствора хлорида магния MgCI2, если кажущаяся степень диссоциации MgCI2 в 0,1н. растворе равна 0,75. Ответ: 2,5 165. Рассчитайте кажущуюся степень диссоциации и нитрата калия KNO3 и хлорида калия KCI в 0,2 н. растворах, если изотонические коэффициенты растворов этих солей соответственно равны 1,78 и 1,81. Ответ: 78%; 81% 166. Вычислите кажущуюся степень диссоциации хлорида магния MgCI2 в водном растворе (ω = 0,5%) с плотностью 1000 кг/м3, если при 18ºС осмотическое давление этого раствора равно 3,2×105 Па. Ответ: 76% 167. Вычислите осмотическое давление раствора гидроксида натрия NaOH при 10ºС, если изотонический коэффициент 0,2 н. NaOH равен 1,8. Ответ: 8,47×105 Па
|
||||||
|
Последнее изменение этой страницы: 2019-05-20; просмотров: 1442; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.126.74 (0.01 с.) |
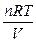 . i =
. i =  =
=  =
= 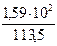 = 1,4.
= 1,4. = i
= i 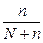 ,
, =
= 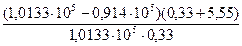 =
=  =
= 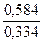 =1,75.
=1,75. ,
, = 1,48/2 = 0,74 (или 74%).
= 1,48/2 = 0,74 (или 74%).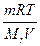 =
= 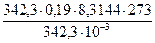 H/м2 = 4,31·105 Па.
H/м2 = 4,31·105 Па. =
=  = 1,9.
= 1,9.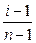 =
=  =
= 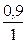 = 0,9 (или 90%).
= 0,9 (или 90%).


