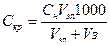Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 5. Устойчивость коллоидных растворов.
Коагуляция. Седиментация
Относительная устойчивость – это способность системы в течении определённого времени сохранять неизменной свою структуру, т.е. размеры частиц и их равномерное распределение в объёме системы. Седиментационная устойчивость – это способность дисперсной системы сохранять неизменным во времени распределение частиц по объёму системы, т.е. способность системы противостоять действию силы тяжести. Действию силы тяжести противостоит диффузия. Соотношение этих факторов, т.е. сидиментационная устойчивость определяется, главным образом, размерами частиц дисперсной фазы. В лиофобных золях размеры частиц малы (10-5 – 10-7 см) и диффузия обеспечивает равномерное распределение частиц в объёме системы. Удельный поток седиментации – это число частиц, оседающих в единицу времени через сечение единичной площади, нормальное к направлению седиментации. Агрегативная устойчивость – это способность системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность. Существует пять факторов, которые могут обеспечить агрегативную устойчивость золя: электростатический, адсорбционно-сольватный, структурно-механический, энтропийный, гидродинамический. Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся слишком крупные и не могут участвовать в броуновском движении. Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии. Скорость коагуляции – это изменение концентрации коллоидных частиц в единицу времени при постоянном объёме системы. Пример 1. Вычисление порога коагуляции электролита с учётом его концентрации. В три колбы налито по 0,01 л золя хлорида серебра AgCl. В первую колбу для коагуляции золя добавлено 0,002 л 1н. нитрата натрия NаNО3, во вторую – 0,012 л 0,01н. нитрата кальция Са(NО3)2, а в третью – 0,007 л 0,001н. нитрата алюминия А1(NО3)3. Вычислите пороги коагуляции электролитов. Определите знак заряда частиц золя. Решение: Порогом коагуляции Скр (ммоль/л) или критической концентрацией называют минимальное количество электролита, прибавляемого к золю, которое может вызвать коагуляцию золя. Порог коагуляции вычисляют по формуле:
где, Сн – нормальная концентрация электролита, моль/л; Vэл, V3 – соответственно объём электролита и золя, л.
Вычисляем пороги коагуляции добавляемых электролитов:
Добавляемые электролиты – NaNO3, Са(NО3)2 и А1(NО3)3 – содержат анион NО3- и катионы Na+, Ca2+, Al3+ разной зарядности. Наименьший порог коагуляции у нитрата алюминия А1(NO3)3, следовательно, частицы золя хлорида серебра заряжены отрицательно.
Пример 2. Вычисление порога коагуляции электролита с учётом заряда иона-коагулятора. Порог коагуляции раствора нитрата калия КNО3 для золя гидроксида алюминия А1(ОН)3, частицы которого заряжены положительно, равен 60,0 ммоль/л. Рассчитайте порог коагуляции К3[Fe(CN)6] для этого золя. Решение: Коагуляцию золя вызывает тот из ионов прибавленного электролита, заряд которого противоположен заряду коллоидной частицы. Коагулирующая способность иона определяется его зарядом. Чем больше заряд иона, тем больше его коагулирующая способность. Значения порогов коагуляции электролитов с одно-, двух- и трёхзарядными ионами относятся как числа: 729: 11: 1. Следовательно порог коагуляции К3[Fе(СN)6] будет в 729 раз меньше чем у нитрата калия, т.е. С К3[Fе(СN)6] = 60/729 = 0,082 ммоль/л. Пример 3. На коагуляцию гидрозоля иодида серебра AgJ из 1,0×10-2 м3 сточных вод потребовалось 8,0×10-4 м3 10%-го раствора хлорида натрия NаСl с плотностью 1,07×103 кг/м3. Рассчитайте расход 28% -го раствора сульфата алюминия А12(SO4)3, плотность которого 1,30×103 кг/м3 для извлечения AgJ из 100 м3 указанных сточных вод, если электрический заряд коллоидных частиц иодида серебра в этих водах: а) положительный; б) отрицательный. Решение: Количество n1 вещества хлорида натрия NaCl в 8,0×10-4 м3 10%-го раствора хлорида натрия NaCl равно: n1 = V1× r1 × w1/ (100M1). n1 = 8,0×10-4 × 1,07×103 × 10/100 × 0,0585 = 1,46 моль., где: V1, r1, w1 – объём (м3), плотность (кг/м3) и концентрация (%) взятого раствора хлорида натрия NaCl; M1 – молярная масса хлорида натрия NaCI (кг/моль).
Отсюда: порог коагуляции Скр сточных вод по хлориду натрия NaCI равен: Скр = VэCн / (V +Vэ) = n1 / (Vэл +Vз) [моль/м3], поэтому: С/кр =1,46/1,0×10-2 + 8,0×10-4 = 1,46×10-2 = 135 моль/м3. а) Если электрический заряд коллоидных частиц положительный, то ионами-коагуляторами в А12(SO4)3 являются ионы SО42- (Z = 2). Порог коагуляции (Скр) рассматриваемого гидрозоля по ионам SО42-, согласно формуле: Скр = kT5/Z6 С//кр = С/кр/26 = 135/64 = 2,12 моль/м3. Следовательно, для коагуляции 100 м3 сточных вод потребуется ионов SО42-: n2 = 2,12× 100 = 212 моль. Масса m2 Al2(SО4)3, содержащая такое количество ионов SO42-, равна: m2 = n2М2/3 = 212 × 0,342/3 = 24,2 кг где М2 – молярная масса Al2(SО4)3; 3 – число ионов SO42- в молекуле Al2(SO4)3. Объём V2 раствора Al2(SO4)3, содержащий такую массу соли, равен: V2 = m2 × 100/w2r2 = 24,2 × 100/28 × 1,30×103 = 6,65×10-2м3 где, w2 и r2 – концентрация (%) и плотность (кг/м3) раствора Al2(SO4)3. б) Если электрический заряд коллоидных частиц отрицательный, то ионами-коагуляторами в Al2(SO4)3 являются ионы A13+ (Z = 3). Порог коагуляции (Скр) рассматриваемого гидрозоля по ионам А13+ согласно формуле равен: С///кр = С/кр /36 = 135/729 =0,186 моль/м3. Для коагуляции сточных вод в этом случае потребуется ионов Al3+: n3 = 0,186 × 100 = 18,6 моль. Масса m3 А12(SO4)3, содержащая такое количество ионов Al3+ равна: m3 = n3М2/2 = 18,6 × 0,342/2 = 3,18 кг где 2 – число ионов А13+ в молекуле А12(SO4)3 Объём V3 раствора А12(SO4)3, содержащий такую массу соли, равен: V3 = m3× 100/w2 r2 = 3,18 × 100/28 × 1,30×103 = 8,74×10-3 м3. Ответы: а) 6,65×10-2м3; б) 8,74×10-змз. Задачи для самостоятельного решения 268. Для некоторого гидрозоля пороги коагуляции электролитов равны: Cк(NaNO3) = 300 ммоль/л; Cк(MgCl2) = 25 ммоль/л; Cк(Na2SO4) = 295 ммоль/л; Ск(АlCl3) = 0,5 ммоль/л. Определите, как заряжены частицы золя. 269. Получен гидрозоль иодида серебра AgJ смешиванием равных объёмов 0,007н. раствора иодида калия KJ и 0,015н. раствора нитрата серебра AgNO3. В качестве коагуляторов взяли сульфат магния MgSO4 и гексацианоферрата железа (III) калия K3[Fe(CN)6]. Какой из этих электролитов будет иметь больший порог коагуляции для данного гидрозоля? 270. Для коагуляции гидрозоля гидроксида железа (III) Fe(OH)3, к 10 мл золя было добавлено в первом случае 2,15 мл 1 н. хлорида калия KCl, во втором – 8,35 мл 0,01н. сульфата натрия Na2SO4 и в третьем случае – 4,8 мл 0,001н. фосфата натрия Na3PO4. Вычислите порог коагуляции каждого электролита и определить знак заряда золя. 271. Пороги коагуляции некоторого золя электролитами равны (ммоль/л): Cк(NaNО3) = 262,0, Ск(Мg(NO3)2) = 23,8, Ск(Fe(NO3)3) = 0,54. Определите, какие ионы электролитов являются коагулирующими, и какой заряд имеют частицы золя. 272. Вычислите порог коагуляции раствора сульфата натрия Na2SO4, если добавление 0,0035 л 0,1 н. Na2SO4 вызывает коагуляцию 0,016 л золя. 273. Частицы золя кремниевой кислоты H2SiO3 заряжены отрицательно. Как расположатся для этого золя пороги коагуляции в ряду K2SO4, CrCl3, Ba(NO3)2? 274. Порог коагуляции Ск(Fe(NO3)3) = 0,076 ммоль/л. Какой объём 0,0003 М Fe(NO3)3 требуется для коагуляции 0,034л золя сульфида мышьяка (III) As2S3? 275. В три колбы налито по 0,12 л золя гидроксида железа(III) Fe(OH)3. Для того чтобы вызвать коагуляцию золя, потребовалось добавить в первую колбу 0,01л 1 н хлорида аммония NH4Cl, а в другую – 0,06л 0,01н сульфата натрия Na2SO4, в третью – 0,037л 0,001н фосфата натрия Na3PO4. Вычислите порог коагуляции каждого электролита и определите знак заряда частиц золя.
276. При сливании 0,2 л 0,06 н. NaOH и 0,55 л 0,002 н. Cu(NO3)2 получен золь гидроксида меди Cu(OН)2. Какой из прибавленных электролитов – Ba(NO3)2, AlCl3, K2CrO4, KBr, MgSO4 имеет наименьший порог коагуляции? 277. Для коагуляции 1,6×10-3 м3 некоторого золя потребовалось 1,3×10-6 м3 раствора NaCl с концентрацией 0,6 кмоль/м3. Определите порог коагуляции золя. 278. Смешиванием равных объемов растворов сульфида натрия Na2S и нитрата кадмия Cd(NO3)2 получен золь сульфида кадмия CdS. Для различных электролитов пороги коагуляции имеют следующие значения (моль/л): Ск(Са(NO3)2) = 265; Cк(NaCl) = 250; Cк(MgCl2) = 290; Cк(Na3PO4) = 0,4; Cк(Na2SO4) = 15; Cк(AlCl3) = 300. Какой из электролитов – сульфида натрия Na2S или нитрата кадмия Cd(NO3)2 – взят в избытке для приготовления золя? 279. Порог коагуляции хлорида натрия NaCl для некоторого золя с положительно заряженными частицами составляет 4,2 ммоль/дм3. Рассчитайте пороги коагуляции этого золя электролитами: а) Na3PO4; б) ZnSO4; в)AlCl3. 280. Порог коагуляции нитрата лития LiNO3 для золя иодида серебра AgI, частицы которого заряжены отрицательно, равен 165 ммоль/л. Вычислите порог коагуляции нитрата бария Ba(NО3)2 и нитрата алюминия Al(NO3)3 для этого золя. 281. Определите, как изменится порог коагуляции электролита для золя бромида серебра AgBr, частицы которого заряжены положительно, если для коагуляции 0,12 л этого золя вместо 0,0016 л 0,1н. раствора сульфата калия K2SO4 взят раствор нитрата железа (III) Fe(NO3)3. 282. Для коагуляции золя сульфида мышьяка (III) As2S3 объёмом 0,052 л, можно добавить один из следующих растворов электролитов: 0,0051 л 2,2н. хлорида натрия NaCl; 0,0051л 0,031н. сульфата натрия Na2SO4; 0,0041л 0,00052н. гексацианоферрата (II) натрия Na4[Fe(CN)6]. У какого из приведенных электролитов наименьший порог коагуляции? 283. Какой концентрации нужно взять раствор хлорида алюминия AlCl3, чтобы 0,009л его хватило для коагуляции 0,135л золя оксида мышьяка (III) As2О3, если порог коагуляции AlCl3 для этого золя равен 0,095 ммоль/л? 284. Каким из электролитов: хлоридом аммония NH4Сl или сульфатом аммония (NH4)2SO4 экономичнее коагулировать золь гидроксида алюминия Al(OН)3, частицы которого заряжены положительно? Рассчитайте порог коагуляции по хлориду аммония NH4Cl, если на коагуляцию частиц из 32 м3 этого золя расходуется 0,34 м3 21%-го раствора NH4Cl (плотность 1062 кг/м3) 285. Для коагуляции сульфида мышьяка (III) As2S3 на 110м3 сточных вод расходуется 1,1 м3 25%-го раствора хлорида натрия NаCl (плотность 1190 кг/м3). Рассчитайте порог коагуляции этого золя по хлориду натрия NаCl. Каким объёмом 25%-го раствора хлорида кальция СаСl2 (плотность 1250 кг/м3) можно вызвать коагуляцию в 110 м3 указанного золя?
286. Речную воду перед подачей в цеха завода осветляют: в неё вводят электролит-коагулятор и образовавшийся ил отстаивают в специальных отстойниках. Рассчитайте расход хлорида натрия NaCl, если расход воды на предприятии составляет 150000 м3/сут, а порог коагуляции по NаCl равен 54 моль/м3. Укажите знак электрических зарядов взвешенных частиц в речной воде. 287. Речную воду перед подачей в цеха завода осветляют: в неё вводят электролит-коагулятор и образовавшийся ил отстаивают в специальных отстойниках. Рассчитайте расход Al2(SO4)3, если расход воды на предприятии составляет 100000 м3/сут, а порог коагуляции по Al2(SO4)3 равен 0,23 моль/м3. Укажите знак электрических зарядов взвешенных частиц в речной воде. 288. Речную воду перед подачей в цеха завода осветляют: в неё вводят электролит-коагулятор и образовавшийся ил отстаивают в специальных отстойниках. Рассчитайте расход сульфата железа (II) FeSO4, если расход воды на предприятии составляет 200000 м3/сут, а порог коагуляции по FeSO4 равен 0,86 моль/м3. Укажите знак электрических зарядов взвешенных частиц в речной воде. 289. Отработанные растворы производства фотоматериалов содержат коллоидное серебро в виде галогенидов. Рассчитайте расход сульфата алюминия Al2(SO4)3 на 200 м3 сточных вод, предполагая, что знак электрических зарядов коллоидных частиц положительный. Порог коагуляции (в моль/м3) для одновалентных ионов равен 144; для двухвалентных – 2,45; для трёхвалентных – 0,066. 290. Отработанные растворы производства фотоматериалов содержат коллоидное серебро в виде галогенидов. Рассчитайте расход сульфата алюминия Al2(SO4)3 на 350 м3 сточных вод, предполагая, что знак электрических зарядов коллоидных частиц положительный. Порог коагуляции (в моль/м3) для одновалентных ионов равен 140; для двухвалентных – 2,42; для трёхвалентных – 0,072. 291. Отработанные растворы производства фотоматериалов содержат коллоидное серебро в виде галогенидов. Рассчитайте расход сульфата алюминия Al2(SO4)3 на 100 м3 сточных вод, предполагая, что знак электрических зарядов коллоидных частиц отрицательный. Порог коагуляции (в моль/м3) для одновалентных ионов равен 143; для двухвалентных – 2,44; для трёхвалентных – 0,065. 292. После добавления к пробе сточных вод объёмом 5,2×10-2м3 раствора хлорида натрия NаCl (плотность 1190 кг/м3) объёмом 2,4×10-3м3 и концентрацией 25% в ней появляются хлопья. Рассчитайте порог коагуляции рассматриваемого золя по отношению к NаCl. Рассчитайте, каким будет расход 25%-го раствора сульфата алюминия Al2(SO4)3 (плотность 1280 кг/м3) на подготовку этих сточных вод к очистке от коллоидных частиц, если знак электрических зарядов коллоидных частиц положительный. 293. После добавления к пробе сточных вод объёмом 5,2×10-2м3 раствора хлорида натрия NаCl (плотность 1190 кг/м3) объёмом 2,4×10-3м3 и концентрацией 25% в ней появляются хлопья. Рассчитайте порог коагуляции рассматриваемого золя по отношению к NаCl. Рассчитайте, каким будет расход 25%-го раствора сульфата алюминия Al2(SO4)3 (плотность 1280 кг/м3) на подготовку этих сточных вод к очистке от коллоидных частиц, если знак электрических зарядов коллоидных частиц отрицательный.
294. Образование гидрозоля вещества С возможно при достаточно медленном введении вещества А в разбавленный раствор вещества В. Напишите формулу мицелл и укажите знак электрического заряда коллоидных частиц этого золя. Объясните, какой из коагуляторов является наиболее экономичным этого золя? А В С Коагулятор 1 KH2SbO4 NaCl NaH2SbO4 K2SO4; NH4Cl; FeCl3; 2 NaOH MgCl2 Mg(OH2) Zn(Ac)2; KCl; AlCl3; 3 AgNO3 NH4CNS AgCNS NaAc; KNO3; Na2SO4; 4 H2SO4 CaCl2 CaSO4 AlCl3; ZnCl2; NaAc; 5 AgNO3 NaI AgI Ca(NO3)2 ; NaF; K2SO4; 295. См. условие задачи 294. А В С Коагулятор 1 CaSO4 BaCl2 BaSO4 AlCl3; NH4Cl; Zn(Ac)2; 2 AgNO3 (NH4)2S Ag2S KАc; Ba(NO3)2; Na2SO4; 3 NaOH AlCl3 Al(OH)3 KNO3; Na2SO4; CaCl2; 4 NH4OH CrCl3 Cr(OH)3 KCl; Na2SO4; BaCl2; 5 NH4OH BeCl2 Be(OH)2 AlCl3; NH4Cl; Zn(Ac)2; 296. См. условие задачи 294. А В С Коагулятор 1 NaOH ZnCl2 Zn(OH)2 K2SO4; NaAc; SrCl2; 2 (NH4)2S MnCl2 MnS K2SO4; BaBr2; NaCl; 3 NaOH FeCl3 Fe(OH)3 KNO3; Na2SO4; MgCl2; 4 Ba(CH3COO)2 K2SO4 BaSO4 AlCl3; NH4Cl; Zn(Ac)2; 5 (NH4)2S ZnCl2 ZnS NaCl; (NH4)2SO4; Ca(NO3)2; 297. См. условие задачи 294. А В С Коагулятор 1 (NH4)2S CoCl2 CoS K2SO4; NaCl; CaCl2; 2 (NH4)2S SnCl2 SnS Ca(Ac)2; Na2SO4; KCl; 3 H2S CdCl2 CdS CaBr2; (NH4)2SO4; NaCl; 4 HCl AgNO3 AgCl NH4NO3; Al(NO3)3; K2SO4; 5 (NH4)2S NiCl2 NiS Na2SO4; NH4Cl; SrCl2; 298. См. условие задачи 294. А В С Коагулятор 1 KI AgNO3 AgI Ca(NO3)2; NaF; K2SO4; 2 H2SO4 Hg(NO3)2 Hg2SO4 NH4NO3; KNO3; Zn(Ac)2; 3 AgNO3 K2CrO4 Ag2CrO4 NH4NO3; Zn(NO3)2; NaAc; 4 KI Hg2(NO3)2 Hg2I2 Zn(NO3)2; KNO3; NaAc; 5 K4[Fe(CN)6] FeCl3 Fe4[Fe(CN)6]3 NH4NO3; K2SO4; AlCl3; 299. См. условие задачи 294. А В С Коагулятор 1 HCl Pb(NO3)2 PbCl2 ZnCl2; NaNO3; Kac; 2 HCl Na2SiO3 H2SiO3 Al(NO3)3; Na2SO4; NH4Cl 3 H2SO4 Pb(NO3)2 PbSO4 NaAc; Zn(NO3)2; (NH4)2SO4 4 (NH4)2S AgNO3 Ag2S CaAc; Ba(NO3)2; KNO3 5 KI Pb(NO3)2 PbI2 NH4NO3; Ca(OH)2; AlBr3; 300. См. условие задачи 294. А В С Коагулятор 1 (NH4)2S Pb(NO3)2 PbS NaAc; Ca(NO3)2; Al(NO3)3 2 (NH4)2C2O4 AgNO3 Ag2C2O4 KАc; NH4NO3; Hac 3 BaCl2 NaF BaF2 Cu(NO3)2; FeCl3; KBr 4 NaOH Bi(NO3)2 Bi(NO)3 NH4NO3; NaNO3; NaAc 5 AgNO3 Na3AsO4 Ag3 AsO4 NH4NO3; Na2 SO4; HNO3 301. См. условие задачи 294. А В С Коагулятор 1 SrCl2 NaF SrF2 NH4NO3; ZnCl2; NaAc 2 H2S Hg(NO3)2 HgS Ca(NO3)2; Ba(NO3)2; NH4Ac 3 H2S CuSO4 CuS CaCl2; HCl; NaSO4 4 NiSO4 Na2S NiS Na2SO4; NH4Cl; SrCl2 5 H2S Bi(NO3)2 Bi2S3 NaNO3; NH4Ac; HCl 302. См. условие задачи 294. А В С Коагулятор 1 KI Hg(NO3)2 HgI2 Zn(Ac)2; KNO2; NH4NO3 2 K3[Fe(CN)6] Zn(NO3)2 Zn3[Fe(CN)6]2 K2SO4; NaCl; NH4NO3 3 K3[Fe(CN)6] FeSO4 Fe3[Fe(CN)6] NH4NO3; KNO3; NaCl 4 Pb(CH3COO)2 (NH4)2S PbS Ca(Ac)2; NaNO3; Al(NO3)3 5 NaOH TiCl4 TiO(OH)2 K2C2O4; NH4OH; AlCl3 303. См. условие задачи 294. А В С Коагулятор 1 AgNO3 K4[Fe(CN)6] Ag4[Fe(CN)6] NaAc; NH4NO3; H2SO4 2 H2S Na3AsO3 As2S3 Na2SO4; NH4Cl; CaCl2 3 AgNO3 Na2SiO3 Ag2SiO3 NH4Cl; HАc; KNO3 4 KBr AgNO3 AgBr NaNO3; K2SO4; Ca(OH)2 5 AgNO3 K3[Fe(CN)6] Ag3 [Fe(CN)6] (NH4)2SO4; KNO3; NaAc
|
|||||||||
|
Последнее изменение этой страницы: 2019-05-20; просмотров: 3225; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.44.108 (0.071 с.) |