
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 2. Растворы – физико-химические системы.
Коллигативные свойства растворов. Растворимость Пример 1. Определение растворимости вещества. Вычислите растворимость BaCI2 в воде при 0ºС, если при этой температуре в 13,1 г раствора содержится 3,1 г BaCI2. Решение. Растворимость (или коэффициент растворимости) выражают массой вещества (г), которое можно растворить в 100 г растворителя при данной температуре. Масса раствора BaCI2 13,1 г. Следовательно, масса растворителя 10 г. Т.о. растворимость BaCI2 при 0 ºС равна 100·3,1/10 = 31 г. Пример 2. Определение массы растворенного вещества, выделяющегося при кристаллизации раствора. Растворимость AlCI3 при 0ºС равна 44,9 г, а при 80ºС – 48,6 г. Какова масса соли, выпадающей в осадок, если при 540,0 г раствора хлорида алюминия охладить от 80 до 0ºС? Решение. Масса раствора AlCI3 равна: а) при 80ºС 100 + 48,6 = 148,6 г; б) при 0ºС 100 + 44,9 = 144,9 г. При охлаждении 148,6 г раствора хлорида алюминия в осадок выпадает 148,6 – 144,9 = 3,7 г AlCI3. Если охладить 540 г раствора AlCI3, то в осадок выпадает: x = Пример 3. Определение массы газа в растворе по его растворимости. Сколько хлороводорода растворится в 100 л воды при 40ºС и давлении 98625 Па, если растворимость HCI при этой температуре (и давлении 1,0133×105 Па) составляет 386 м3 на 1 м3 воды? Решение. Определяем объём HCI, содержащегося в 100 л воды при 40ºС и давлении 1,0133×105 Па: 1000 л H2O — 386 м3 100 л H2O — х м3 х = Массу HCI вычисляем по уравнению Менделеева – Клайперона; М (HCI) = 36,46 г/моль. Тогда: m = Пример 4. Определение состава газовой смеси по растворимости газов. Газовая смесь, содержащая 21% O2 и 79% N2, пропущена через воду при 0ºС и давлении 1,0133×105 Па. Вычислите объёмные доли φ газовой смеси, растворённой в воде, если растворимость кислорода и азота в воде при этой температуре и давлении соответственно равна 0,049 и 0,0236 м3 на 1 м3 воды. Решение. Согласно закону Генри растворимость (Р) газа в воде пропорциональна его парциальному давлению в смеси. Определим парциальное давление газов в смеси: p О2 = 1,0133 × 105 × 0,21 = 0,2128 × 105 Па; p Учитывая парциальные давления, определяем растворимость газов: Р Р Общий объём азота и кислорода; 0,0104 + 0,0189 = 0,0293 м3. Тогда объёмная доля газов и смеси составит (%):
φ Задачи для самостоятельного решения
81. При 100ºС коэффициент растворимости хлорида кальция CaCl2 в воде равен 158 г на 100 г воды. Расчитайте, какая масса хлорида кальция при этой температуре содержится в 1,35 кг раствора соли? Ответ: 827,8 г 82. При 0ºС 50 г раствора содержат 3,44 г сульфата калия K2SO4. Вычислит массовую долю соли и его коэффициент растворимости при данных условиях. Ответ: 6,88%; 7,40 г. 83. 500 г раствора хлорида кобальта при 20ºС содержат 173 г соли. Определите массовую долю CоCl2 и растворимость. Ответ: 34,6%; 52,7 г. 84. Какая масса сульфата меди выпадет в осадок, если охладить 825 г раствора от 100 до 20ºС, если растворимость CuSO4 при 20 ºС и 100 ºС равна соответственно 20,2 и 77г? Ответ: 264,7 г. 85. В 100 г растворителя при 100ºС содержится 155 г соли K2СO3, а при 0ºС 111 г. Определите массу карбоната калия, выпавшего в осадок из 770 г насыщенного при 100ºС раствора и охлаждённого до 0ºС. Ответ: 132,9 г 86. Растворимость соли при 90ºС и 25ºС соответственно составляет 42,7 и 6,9г. Какую массу воды и соли надо взять, если при охлаждении насыщенного при 90ºС раствора до 25ºС выкристаллизовалось 200 г соли? Ответ: 558,7 г; 238,5 г 87. Какова масса диоксида углерода, содержащегося в 25 л Н2О, при 0ºС и давлении 0,745×105 Па, если растворимость СО2 в воде при этой температуре и давлении 1,0133×105Па равна 1,713 м3 на 1 м3 воды? Ответ: 62 г. 88. Растворимость хлора при 10ºС и давлении 1,0133×105 Па составляет 3,148 м3 на 1м3 воды. Какой объём воды надо взять, чтобы растворить 250 г хлора при 10ºС и давлении 1,5×105Па? Ответ: 17,5 л. 89. Растворимость сероводорода при 20 ºС и давлении 1,0133×105 Па равна 2,91 л на 1 л воды. Вычислите массовую долю Н2S в полученном растворе. Ответ: 0,4 % 90. Под каким давлением должен находиться диоксид углерода, чтобы при растворении его в воде получили раствор с массовой долей СО2 1%? Коэффициент абсорбции СО2 при 20 ºС равен 0,878. Ответ: 6,37×105 Па
91. Определите массовую долю HCI в растворе, полученном при растворении 4,9 л хлороводорода в 0,05 л воды при 18ºС и давлении 1,0×105 Па. Ответ: 12,87 % 92. Каково массовая доля (%) водорода в растворе при 30ºС и давлении 965000 Па, если коэффициент абсорбции водорода водой при 30ºС составляет 0,017? Ответ: 0,13 % 93. Газовая смесь, состоящая из водорода и оксида углерода (IV), растворена в воде при 10ºС и давлении 1,0133×105 Па. Определите объёмные доли Н2 и СО2 в газовой смеси, растворённой в воде, если коэффициенты абсорбции Н2 и СО2 соответственно равны 0,0199 и 1,194. Ответ: 1,09; 98,91 % 94. В воде при 20ºС и общем давлении 2,5×105 Па растворена газовая смесь, состоящая из О2, N2 и Cl2. Объёмные доли этих газов в смеси соответственно равны 15, 25 и 60 %. Растворимость газов в 1 м3 воды (м3): РО2 = 0,031; РN2 = 0,016; РCl2 = 2,299. Определите объёмные доли газов в газовой смеси, растворённой в воде. Ответ: 0,23; 0,27, 99,5 %
Энергетика растворения Пример 1. Определение теплоты растворения вещества. При растворении 8 г хлорида аммония в 29 г воды температура понизилась на 2ºС. Вычислите теплоту растворения NH4CI в воде, принимая удельную теплоёмкость полученного раствора равной теплоёмкости воды 4,1870Дж/(г·К). Решение: Теплота растворения Δ H раств – количество теплоты, поглощающейся (или выделяющейся) при растворении 1 моль вещества в таком объёме растворителя, дальнейшее прибавление которого не вызывает изменения теплового эффекта. Теплота растворения имеет отрицательные значения, если при растворении теплота поглощается, и положительные, если теплота выделяется. Количество теплоты, выделяемое при нагревании или охлаждении тела, равно: Q = cm Δ T, где с – удельная теплоёмкость вещества, Дж/ (г·К); m – масса вещества, г; Δ T – изменение температуры. При растворении 8 г NH4CI в 291 г воды поглощается следующее количество теплоты: Q = 4,187 · 291 (–2) = –2435,1 Дж. Для определения теплоты растворения NH4CI составляем пропорцию, M (NH4CI) = 53,49 г /моль: 8 г NH4CI – (–2435,1) Дж 53,49 г NH4CI – x Дж X = Следовательно, Δ H раств = –16,3 кДж/моль. Пример 2. Определение теплоты гидратации вещества. При растворении 52,06 г BaCI2 в 400 моль H2O выделяется 2,16кДж теплоты, а при растворении 1 моль BaCI2×2H2O в 400 моль H2O поглощается 18,49 кДж теплоты. Вычислите теплоту гидратации безводного BaCI2. Решение: Теплота гидратации Δ H ºгидр – теплота, выделяемая при взаимодействии 1 моль растворяемого вещества с растворителем – водой. Процесс растворения безводного BaCI2 можно представить следующим образом: а) гидратация безводной соли BaCI2 BaCI2 + 2H2O = BaCI2×2H2O + Δ H ºгидр б) растворение образовавшегося гидрата BaCI2×2H2O+aq*→ BaCI2×2H2O(aq) + Δ H ºраст. Количество теплоты Δ H º, выделяющееся при растворении безводного BaCI2, равно алгебраической сумме тепловых эффектов этих двух процессов: Δ H º = Δ H ºгидр + Δ H ºраств; Δ H ºгидр = Δ H º – Δ H ºраств. Для вычисления теплоты гидратации безводного хлорида бария надо определить теплоту растворения BaCI2 для тех же условий, что и для BaCI2×2H2O, т.е. для 1 моль BaCI2 (раствор в обоих случаях должен иметь одинаковую концентрацию); M
52,06 г BaCI2 – 2,16 кДж 208,25 г BaCI2 – х кДж х = Следовательно, Δ H ºраств = 8,64 кДж/моль; Δ H ºгидр = 8,64 – (–18,49) = 27,13 кДж/моль. Пример 3. Вычисление теплового эффекта реакции растворения. Рассчитайте тепловой эффект реакции растворения алюминия в разбавленной соляной кислоте, если стандартные теплоты образования реагирующих веществ равны (кДж/моль): Δ H º Решение: Реакция растворения Al в соляной кислоте протекает по уравнению 2Al + 6HCI(aq) = 2AlCI3(aq) + 3H2. Тепловой эффект реакции растворения равен: Δ H º298 = 2Δ H º
Пример 4. Определение возможности протекания реакции растворения по значению энергии Гиббса. Будет ли растворятся сульфид меди в разбавленной серной кислоте, если энергия Гиббса реагирующих веществ равна (кДж/моль):
Δ G º CuS(к) = –48,95; Δ G º Δ G º Решение: Для ответа на вопрос задачи необходимо подсчитать Δ G º298 реакции. Реакция растворения CuS в разбавленной H2SO4 могла бы протекать по уравнению: CuS(к) + H2SO4(aq) = CuSO4(aq) + H2S(г) Δ G º298 = Δ G º = – 677,5 – 33,02 + 742,5 + 48,95 = + 80,97 кДж/моль. Так как Δ G º > 0, реакция невозможна, т.е. CuS не будет растворяться в разбавленной H2SO4.
Задачи для самостоятельного решения
95. В 545 г раствора нитрата бария при при 20ºС содержится 45 г соли. Вычислите растворимость Ba(NO3)2 в воде этой температуре. Ответ: 9 г. 96. Высчитайте теплоту растворения хлорида натрия NaCI, если при растворении в воде 23,38 г NaCI поглощается 2,14 кДж теплоты. Ответ: 5,35 кДж/моль 97. Какое количество теплоты выделится при растворении в воде 225 г гидроксида натрия NaOH, если теплота растворения NaOH в воде равна 41,6 кДж/моль? Ответ: –234 кДж 98. При растворении 25 г хлорида калия KCI в 1 л H2O температура понизилась на 1,5º. Вычислите теплоту растворения KCI в воде, если удельная теплоёмкость полученного раствора равна 4,18 кДж/(г·К). Ответ: 18,7 кДж 99. Какую массу нитрата аммония NH4NO3 надо растворить в 0,2 л воды, чтобы понизить температуру на 5º? Теплота растворения NH4NO3 равна –26,32 кДж/моль. Удельная теплоемкость полученного раствора равна 3,77 Дж/(г·К). Ответ: 11,46 г 100. На сколько градусов повысится температура, если в 250 мл воды растворить 6 г карбоната натрия Na2CO3? Теплота растворения Na2CO3 в воде равна 25,6 кДж/моль. Удельную теплоёмкость раствора принять равной 4,174 Дж/(г·К). Ответ: 1,38ºС
101. При растворении 4,0 г сульфата меди CuSO4 в 0,2 л воды температура повысилась на 2º. Вычислите теплоту гидратации CuSO4, если теплота растворения кристаллогидрата сульфата меди CuSO4×5H2O равна –11,72 кДж/моль. Удельная теплоёмкость раствора равна 4,18 Дж/(г·К). Ответ: –78,44 кДж/моль 102. При растворении 38,1 г кристаллогидрата сульфата магния MgSO4×6H2O в 7208 г H2O поглощается 70 Дж теплоты. Рассчитайте теплоту гидратации сульфата магния MgSO4, если теплота растворения 1 моль MgSO4 в 400 моль воды равна 84,94 кДж/моль. Ответ: –85,36 кДж/моль 103. Рассчитайте теплоту растворения безводного сульфита натрия Na2SO3 в воде, если при растворении 1 моль кристаллогидрата сульфита натрия Na2SO3×7H2O в 800 моль воды поглощается 46,86 кДж теплоты. Теплота гидратации Na2SO3 равна 58,16 кДж/моль. Ответ: –11,3 кДж/моль 104. На сколько градусов повысится температура при растворении 1 моль сульфата цинка ZnSO4 в 400 моль воды H2O, если теплота растворения 1 моль кристаллогидрата сульфата цинка ZnSO4×7H2O в 400 моль равна –17,70 кДж/моль? Теплота гидратации безводного сульфата цинка равна 95,27 кДж/моль. Теплоёмкость раствора равна 4,19 Дж/(г·К). Ответ: 2,56ºС 105. Определите теплоту гидратации гидрофосфата натрия Na2HPO4, если при растворении 14,2 г Na2HPO4 в 7208 г воды выделяется 2,36 кДж теплоты, а при растворении 35,8 г кристаллогидрата гидрофосфата натрия Na2HPO4×12H2O в том же количестве воды поглощается 9,51 кДж теплоты. Ответ: –118,7 кДж/моль 106. Определите тепловой эффект реакции растворения натрия Na в воде, если Δ H NaOH(aq) = –469,93 кДж/моль. Ответ: –368,2 кДж 107. Каким тепловым эффектом будет сопровождаться растворение железа Fe в разбавленной соляной кислоте, если стандартные теплоты образования HCI(aq) и FeCI2(aq) соответственно равны –167,5 и –422,9 кДж/моль? Ответ: –87,9 кДж/моль 108. Вычислите изменение величины энергии Гиббса для системы NH3(г) + H2O(ж) = NH4OH(aq) если ΔGº Ответ: – 8,66 кДж/моль 109. Будет ли растворяться сульфат бария BaSO4 в разбавленной соляной кислоте HCI, если величина энергии Гиббса реагирующих веществ равна (кДж/моль): ΔGºBaSO 110. Вычислите изменение энтропии реакции растворения калия К в воде, если SºKOH(ba) = 92,21 Дж/(моль·K). Ответ: 46,6 Дж(моль·К) 111. Каково изменение энтропии системы KCI (ag) + NaOH (ag) = KOH (ag) + NaCI (ag) если SºKCI(ag) = 157,85; SºNaOH(ag) = 49,74; SºKOH(ag) = 92,11;
SºNaCI(ag) = 115,56Дж/(моль·K) Ответ: 0,09Дж/(моль·K)
Осмотическое давление
|
|||||||||
|
Последнее изменение этой страницы: 2019-05-20; просмотров: 2231; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.126.241 (0.053 с.) |
 = 13,4 г (AlCI3)
= 13,4 г (AlCI3) м3
м3 =
=  53,4 кг.
53,4 кг. = 1,0133 × 105 × 0,79 = 0,8005 × 105 Па.
= 1,0133 × 105 × 0,79 = 0,8005 × 105 Па.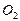 =
= 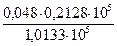 = 0,0104 м3;
= 0,0104 м3; = 0,0189 м3.
= 0,0189 м3. = –16,282 = –16,3 кДж.
= –16,282 = –16,3 кДж. = 208,25 г/моль:
= 208,25 г/моль: = 8,64 кДж.
= 8,64 кДж.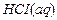 = –167,5;
= –167,5; 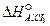 (aq) = – 672,3.
(aq) = – 672,3. – 6Δ H º
– 6Δ H º 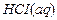 = 2(–672,3) – (–167,5)6 = –339,6 кДж.
= 2(–672,3) – (–167,5)6 = –339,6 кДж.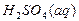 = –742,5;
= –742,5;  = –677,5, Δ G º
= –677,5, Δ G º 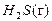 = –33,02.
= –33,02. =
=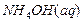 = – 263,8 кДж/моль.
= – 263,8 кДж/моль.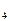 1к) = –1353,1; ΔGºHCI(aq) = –131,3; ΔGº
1к) = –1353,1; ΔGºHCI(aq) = –131,3; ΔGº 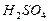
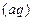 = –742,5; ΔGº
= –742,5; ΔGº 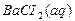 = –823,1.
= –823,1.


