
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Буферные растворы. Буферная ёмкость
Пример 1. Вычисление рН буферного раствора. 1 л буферного раствора содержит 0,01 моль ацетата натрия СН3СООNa и 0,1 моль уксусной кислоты СН3СООН. Найдите рН этого буферного раствора. Константа диссоциации уксусной кислоты равна Ксн3соон = 1,75×10-5. Решение: Буферными называют растворы, одновременно содержащие слабую кислоту и её соль (слабое основание и его соль) и обладающие свойством сохранять практически неизменной концентрацию ионов водорода при разбавлении, добавлении небольших количеств кислот или щелочей. Для любой слабой кислоты НА:
При добавлении к раствору слабой кислоты раствора сильного электролита (соли этой кислоты) концентрация аниона А- значительно возрастает за счёт диссоциации соли. Так как сильные электролиты диссоциируют практически полностью, то концентрацию аниона А- можно считать равной концентрации соли: [А-] = [соли]. Концентрацию недиссоциированной части слабой кислоты можно приравнять к общей концентрации кислоты, пренебрегая очень малой долей распавшихся молекул: [НА] = [кисл.]
Для нашей задачи: рН = –lg 1,75×10-4 = 3,76 Ответ: 3,76 Пример 2. Вычисление концентрации ионов Н+ в буферном растворе при его разбавлении. 1 л буферного раствора содержит 0,1 моль хлорида аммония NН4СI и 0,01 моль гидроксида аммония NН4ОН. (КNН4ОН = 1,77×10-5). Найдите концентрацию ионов водорода [Н+] в буферном растворе. Как изменится [Н+] при разбавлении раствора в 100 раз? Решение: Рассуждая аналогично примеру 1, получим соотношение для вычисления концентрации гидроксид-ионов [ОН-] в буферном растворе, содержащем слабое основание и его соль:
Для нашей задачи: При разбавлении буферного раствора в 100 раз концентрация каждого из компонентов уменьшается в 100 раз: [NН4СI] = 0,001 моль/л; [NН4ОН] = 0,0001 моль/л.
Итак, при разбавлении буферного раствора в 100 раз концентрация ионов Н+ не меняется. Ответ: [Н+] = 0,56×10-8 моль/л; концентрация [Н+] не меняется. Пример 3. Вычисление рН буферного раствора при добавлении сильной кислоты.
1 л формиатного буферного раствора содержит по 0,1 моль/л НСООNа и НСООН (К дис = 1,77×10-4). Определите, как изменится рН этого буферного раствора, после добавления к нему 0,01 моль НСI. Решение: Найдём концентрацию ионов водорода [Н+] и рН в исходном буферном растворе.
При добавлении к 1 л буферного раствора 0,01 моль НСI произойдет реакция, в результате которой концентрация НСООН увеличится на 0,01 моль, т.е. будет равной 0,1 + 0,01 = 0,11 моль/л, а концентрация НСООNа соответственно уменьшится на 0,01 моль: 0,1 – 0,01 = 0,09 моль/л. После прибавления к формиатному буферному раствору НСI получим:
Таким образом, при прибавлении сильной кислоты рН раствора уменьшилось на 3,75 – 3,67 = 0,08 единиц. Ответ: рН уменьшилось на 0,08 Пример 4. Вычисление буферной ёмкости раствора. 1 л формиатного буферного раствора содержит по 1 моль НСООNа и НСООН (К дис = 1,77×10-4). Рассчитайте буферную ёмкость раствора, по отношению к НСI и NаОН (ВHCl; BNaOH). Решение: Буферная ёмкость раствора характеризует способность буферного раствора поддерживать постоянное значение рН при добавлении кислоты или щелочи. Буферную ёмкость раствора выражают количеством кислоты или щелочи, которое необходимо добавить к 1 л буферного раствора, чтобы понизить или повысить рН раствора на единицу. Добавление к буферному раствору кислоты понижает, а добавление щелочи увеличивает рН раствора. Буферная ёмкость раствора тем больше, чем выше концентрация его компонентов. Для исходного раствора:
При добавлении НСI к буферному раствору протекает реакция: НСООNа + НСI = НСООН + NаСI Через хмоль обозначим буферную ёмкость раствора по отношению к соляной кислоте. Тогда при добавлении к 1 л раствора х моль НСI концентрация НСООН увеличится до (1 + х) моль/л, а концентрация НСООNа уменьшится до (1 – х) моль/л. При добавлении НСI в количестве, равном буферной ёмкости раствора, рН раствора понизится на единицу, т.е. будет равным 2,75. В этом случае [Н+] = 1,78×10-3 моль/л, [Н+] =
х = 0,818. Т. о., буферная ёмкость раствора по отношению к НСI равна 0,818 моль/л.
При добавлении NаОН к буферному раствору протекает реакция: НСООН + NаОН = НСООNа + Н2О Через у моль обозначим буферную ёмкость раствора по отношению к NаОН. При добавлении у моль гидроксида натрия к 1 л раствора концентрация соли увеличится до (1 + у) моль/л; концентрация кислоты НСООН уменьшится до (1 – у) моль/л. При добавлении NаОН в количестве, равном буферной ёмкости раствора по отношению к NаОН, рН раствора увеличится на единицу и будет равным 4,75; [Н+] = 1,78×10-5 моль/л. 0,1 (1 + у) = 1 – у; 0,1 + 0,1 у = 1 – у; 1,1 у = 0,9; у = 0,818. Буферная ёмкость раствора по отношению к NаОН также равна 0,818 моль/л. Ответ: 0,818; 0,818 Задачи для самостоятельного решения 168. 1 л буферного раствора содержит 0,04 моль формиата натрия HCOONa и 0,06 моль муравьиной кислоты НСООН (К дис = 1,7×10-4). Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. 169. 2 л буферного раствора содержат 0,06 моль формиата натрия HCOONa и 0,12 моль муравьиной кислоты НСООН (К дис = 1,7×10-4). Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. 170. 1 л буферного раствора содержит 0,01 моль ацетата натрия СН3СООNa и 0,01 моль уксусной кислоты СН3СООН (К дис = 1,75×10-5). Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. Как отличается концентрация ионов водорода [Н+] в буферном растворе от концентрации ионов водорода [Н+] в 0,01 М растворе уксусной кислоты? 171. 2 л буферного раствора содержат 0,05 моль ацетата натрия СН3СООNa и 0,05 моль уксусной кислоты СН3СООН (К дис = 1,75×10-5). Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. Как отличается концентрация ионов водорода [Н+] в буферном растворе от концентрации ионов водорода [Н+] в 0,05 М растворе уксусной кислоты? 172. 1 л буферного раствора содержит 0,02 моль карбоната аммония (NH4)2CO3 и 0,2 моль гидроксида аммония NН4ОН (К дис = 1,77×10-5). Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора и раствора, полученного при разбавлении исходного в 10 раз. 173. 3 л буферного раствора содержат 0,25 моль карбоната аммония (NH4)2CO3 и 2,5 моль гидроксида аммония NН4ОН (К дис = 1,77×10-5). Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора и раствора, полученного при разбавлении исходного в 100 раз. 174. 4 л буферного раствора содержат 0,005 моль формиата натрия HCOONa и 0,05 моль муравьиной кислоты НСООН (К дис = 1,77×10-4). Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. 175. 1 л буферного раствора содержит 0,002 моль формиата натрия HCOONa и 0,02 моль муравьиной кислоты НСООН (К дис = 1,77×10-4). Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. 176. 1 л буферного раствора содержит 0,01 моль ацетата натрия СН3СООNа и 0,1 моль уксусной кислоты СН3СООН (К дис = 1,75×10-5). Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. 177. 5 л буферного раствора содержат 0,05 моль ацетата натрия СН3СООNа и 0,5 моль уксусной кислоты СН3СООН (К дис = 1,75×10-5). Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. 178. 1 л буферного раствора содержит 0,03 моль ацетата натрия СН3СООNа и 0,15 моль уксусной кислоты СН3СООН (К дис = 1,75×10-5). Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора и раствора, полученного при при добавлении 0,02 моль НСI.
179. 2 л буферного раствора содержат 0,06 моль ацетата натрия СН3СООNа и 0,25 моль уксусной кислоты СН3СООН (К дис = 1,75×10-5). Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора и раствора, полученного при добавлении 0,03 моль НСI. 180. В 600 мл воды растворили 2 г муравьиной кислоты НСООН (К дис = 1,77×10-4) и 2 г формиата натрия HCOONa. Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. 181. В 1200 мл воды растворили 12 г муравьиной кислоты НСООН (К дис = 1,77×10-4) и 8 г формиата натрия HCOONa. Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. 182. 1 л буферного раствора содержит 0,02 моль ацетата натрия СН3СООNа и 0,25 моль уксусной кислоты СН3СООН (К дис = 1,75×10-5). Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора и растворов, полученных при добавлении 0,015 моль соляной кислоты НСI, при добавлении 0,015 моля гидроксида натрия NaOH. 183. 2 л буферного раствора содержат 0,035 моль ацетата натрия СН3СООNа и 0,35 моль уксусной кислоты СН3СООН (К дис = 1,75×10-5). Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора и растворов, полученных при добавлении 0,025 моль соляной кислоты НСI, при добавлении 0,15 моля гидроксида натрия NaOH. 184. Буферный раствор имеет рН = 2. Найдите соотношение концентраций муравьиной кислоты НСООН (К дис = 1,77×10-4) и формиата натрия HCOONa, необходимое для получения данного буферного раствора. 185. Буферный раствор имеет рН = 3. Найдите соотношение концентраций муравьиной кислоты НСООН (К дис = 1,77×10-4) и формиата натрия HCOONa, необходимое для получения данного буферного раствора. 186. Буферный раствор имеет рН = 5. Концентрация синильной кислоты HCN (К дис = 4,9×10-10) равна 0,22 М. Найдите концентрацию цианида калия KCN в буферном растворе. 187. Буферный раствор имеет рН = 6. Концентрация синильной кислоты HCN (К дис = 4,9×10-10) равна 0,12 М. Найдите концентрацию цианида калия KCN в буферном растворе. 188. Найдите объём 2%-ного раствора гидроксида натрия NaOH, который необходимо добавить к 35 мл 0,2 М раствора муравьиной кислоты НСООН (К дис = 1,77×10-4), для того чтобы получить буферный раствор с рН = 4,26? 189. Найдите объём 3%-ного раствора гидроксида натрия NaOH, который необходимо добавить к 45 мл 0,25 М раствора муравьиной кислоты НСООН (К дис = 1,77×10-4), для того чтобы получить буферный раствор с рН = 5,42? 190. 1 л буферного раствора содержит 3 моль гидроксида аммония NН4ОН (Кдис = 1,77×10-5) и 2 моль хлорида аммония NН4СI. Найдите буферную ёмкость раствора по отношению к соляной кислоте НСI и гидроксиду натрия NаОН (ВHCl; BNaOH).
191. 2 л буферного раствора содержат 5 моль гидроксида аммония NН4ОН (Кдис = 1,77×10-5) и 5 моль хлорида аммония NН4СI. Найдите буферную ёмкость раствора по отношению к соляной кислоте НСI и гидроксиду натрия NаОН (ВHCl; BNaOH). 192. 1 л буферного раствора содержит 2 моль муравьиной кислоты НСООН (К дис = 1,77×10-4) и 2 моль формиата натрия HCOONa. Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора после добавления 15,5 г хлороводорода НСI. 193. 1 л буферного раствора содержит 4 моль муравьиной кислоты НСООН (К дис = 1,77×10-4) и 4 моль формиата натрия HCOONa. Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора после добавления 25,0 г хлороводорода НСI. 194. 1 л буферного раствора содержит 0,15 моль ацетата натрия СН3СООNа и 0,25 моль уксусной кислоты СН3СООН (К дис = 1,75×10-5). Найдите буферную ёмкость раствора по отношению к соляной кислоте НСI и гидроксиду натрия NаОН (ВHCl; BNaOH). 195. Буферный раствор получен при смешении 2,5 л 1,5 М раствора гидроксида аммония NН4ОН (Кдис = 1,77×10-5) и 1,5 л 1,0 М раствора хлорида аммония NН4СI. Найдите буферную ёмкость раствора по отношению к соляной кислоте НСI (ВHCl). 196. Буферный раствор получен при смешении 2,5 л 1,5 М раствора гидроксида аммония NН4ОН (Кдис = 1,77×10-5) и 1,5 л 1,0 М раствора хлорида аммония NН4СI. Найдите буферную ёмкость раствора по отношению к гидроксиду натрия NаОН (BNaOH). 197. Буферный раствор получен при смешении 1,5 л 1,5 М раствора гидроксида аммония NН4ОН (Кдис = 1,77×10-5) и 0,8 л 0,8 М раствора хлорида аммония NН4СI. Найдите буферную ёмкость раствора по отношению к гидроксиду натрия NаОН (BNaOH). 198. 1 л буферного раствора содержит 0,05 моль ацетата натрия СН3СООNа и 0,2 моль уксусной кислоты СН3СООН (К дис = 1,75×10-5). Найдите буферную ёмкость раствора по отношению к соляной кислоте НСI и гидроксиду натрия NаОН (ВHCl; BNaOH). 199. Буферный раствор получен при смешении 1,5 л 1,5 М раствора гидроксида аммония NН4ОН (Кдис = 1,77×10-5) и 0,8 л 0,8 М раствора хлорида аммония NН4СI. Найдите буферную ёмкость раствора по отношению к соляной кислоте НСI (ВHCl). 200. Буферный раствор получен при смешении 2,3 л 2,0 М раствора гидроксида аммония NН4ОН (Кдис = 1,77×10-5) и 1,2 л 1,5 М раствора хлорида аммония NН4СI. Найдите буферную ёмкость раствора по отношению к гидроксиду натрия NаОН (BNaOH). 201. В 1 л воды растворили 2,0 мл 6%-ного раствора муравьиной кислоты НСООН (К дис = 1,77×10-4) и 0,5 мл 4%-ного раствора гидроксида калия КОН. Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. 202. В 1 л воды растворили 1,5 мл 5%-ного раствора муравьиной кислоты НСООН (К дис = 1,77×10-4) и 0,5 мл 3%-ного раствора гидроксида калия КОН. Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. 203. Буферный раствор получен при смешении 60 мл 0,2 н раствора гидроксида аммония NН4ОН (Кдис = 1,77×10-5) и 35 мл 0,15 н раствора соляной кислоты НСI. Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора.
204. Буферный раствор получен при смешении 100 мл 0,35 н раствора гидроксида аммония NН4ОН (Кдис = 1,77×10-5) и 50 мл 0,25 н раствора соляной кислоты НСI. Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. 205. Буферный раствор получен при смешении 25 мл 0,25 М раствора двузамещенного фосфата калия K2HPO4 и 15 мл 0,3 М раствора соляной кислоты НСI. Показатели констант диссоциации фосфорной кислоты равны: рК1 = 2,12; рК2 = 7,2; рК3 = 11,9. Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. 206. 3,4563 г двузамещенного фосфата калия K2HPO4 растворили в 250 мл воды. Для получения буферного раствора к этому раствору добавлено 50 мл 0,1078 М раствора соляной кислоты НСI. Найдите концентрацию ионов водорода [Н+] и рН этого буферного раствора. 207. К 25 мл 0,15 М раствора двузамещенного фосфата калия добавлено 25 мл 0,1 М раствора хлороводородной кислоты. Вычислить рН полученного раствора.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2019-05-20; просмотров: 2524; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.187.103 (0.03 с.) |
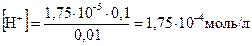

 рН = –lg 1,77×10-4 = 3,75.
рН = –lg 1,77×10-4 = 3,75. рН = –lg 2,16×10-4 = 3,67.
рН = –lg 2,16×10-4 = 3,67. ; рН = –lg 1,77×10-4 = 3,75.
; рН = –lg 1,77×10-4 = 3,75.
 ; 1 – х = 0,1 (1 + х); 1 – х = 0,1 + 0,1 х; 0,9 = 1,1 х;
; 1 – х = 0,1 (1 + х); 1 – х = 0,1 + 0,1 х; 0,9 = 1,1 х;



