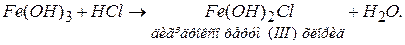Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні класи неорганічних сполукСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ОСНОВНІ ПОНЯТТЯ ТА ВИЗНАЧЕННЯ
Найважливішими класами неорганічних сполук за функціональними ознаками є оксиди, кислоти, основи, амфотерні гідроксиди, солі.
ПРИКЛАДИ ВИКОНАННЯ ЗАВДАНЬ Приклад 1. Скільки солей можна одержати при взаємодії натрій гідроксиду NaOH з фосфатною кислотою? Відповідь. Якщо взяти реагуючі речовини в еквівалентних кількостях, одержимо середню або нормальну сіль натрій фосфат Na3PO4
а якщо взяти надлишок кислоти, то одержимо кислі солі, які є продуктом неповного заміщення атомів Гідрогену в молекулі кислоти на метал
Відповідь: 3 солі.
Приклад 2. Скільки солей можна одержати при взаємодії ферум(III) гідроксиду з хлоридною кислотою? Відповідь. Якщо взяти реагуючі речовини в еквівалентних кількостях, одержимо середню сіль ферум(III) хлорид:
а якщо взяти надлишок Fe(OH) 3, одержимо основні солі, які є продуктом неповного заміщення гідроксидних груп ОН- на кислотний залишок. Саме тому в їхніх молекулах крім атомів металу і кислотних залишків містяться одна або дві групи ОН-:
Відповідь: 3 солі. КОНТРОЛЬНІ ЗАВДАННЯ 61. Скільки солей можна одержати при взаємодії кальцій гідроксиду з сульфатною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 3 солі.
62. Скільки солей можна одержати при взаємодії магній гідроксиду з фосфатною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 4 солі.
63. Скільки солей можна одержати при взаємодії купрум(II) гідроксиду з фосфатною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 4 солі.
64. Скільки солей можна одержати при взаємодії цинк гідроксиду з карбонатною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 3 солі.
65. Скільки солей можна одержати при взаємодії ферум(II) гідроксиду з силікатною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 3 солі.
66. Скільки солей можна одержати при взаємодії алюміній гідроксиду з хлоридною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 3 солі.
67. Скільки солей можна одержати при взаємодії алюміній гідроксиду з сульфатною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 4 солі.
68. Скільки солей можна одержати при взаємодії алюміній гідроксиду з бромідною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 3 солі.
69. Скільки солей можна одержати при взаємодії алюміній гідроксиду з фосфатною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 5 солей.
70. Скільки солей можна одержати при взаємодії барій гідроксиду з нітритною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 2 солі.
71. Скільки солей можна одержати при взаємодії барій гідроксиду з силікатною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 3 солі.
72. Скільки солей можна одержати при взаємодії барій гідроксиду з сульфідною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 3 солі.
73. Скільки солей можна одержати при взаємодії барій гідроксиду з фосфатною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 4 солі.
74. Скільки солей можна одержати при взаємодії хром(Ш) гідроксиду з іодидною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 3 солі.
75. Скільки солей можна одержати при взаємодії хром(Ш) гідроксиду з сульфатною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 4 солі.
76. Скільки солей можна одержати при взаємодії хром(Ш) гідроксиду з сульфітною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 4 солі.
77. Скільки солей можна одержати при взаємодії хром(Ш) гідроксиду з фосфатною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 5 солей.
78. Скільки солей можна одержати при взаємодії ферум(Ш) гідроксиду з сульфатною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 4 солі.
79. Скільки солей можна одержати при взаємодії ферум(П) гідроксиду з фосфатною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 4 солі.
80. Скільки солей можна одержати при взаємодії ферум(Ш) гідроксиду з карбонатною кислотою? Скласти рівняння реакцій утворення відповідних солей. Відповідь: 4 солі.
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 705; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.13.15 (0.006 с.) |




 ,
,