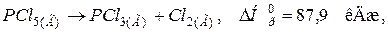Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термохімія та термохімічні розрахункиСодержание книги
Поиск на нашем сайте
ОСНОВНІ ПОНЯТТЯ ТА ВИЗНАЧЕННЯ
ПРИКЛАДИ ВИКОНАННЯ ЗАВДАНЬ
При виконанні завдань цього розділу див. табл. 5. Приклад 1. Визначення маси реагуючих речовин за величиною теплового ефекту реакції. При взаємодії алюмінію з йодом, виділилось 77 кДж теплоти. Які маси речовин прореагували? Теплота утворення алюміній іодиду дорівнює Розв’язання. Записуємо термохімічне рівняння, враховуючи, що
На підставі термохімічного рівняння складаємо пропорції та розв’язуємо їх: а) MAl=27 г/моль; 27 г Al реагують з виділенням 308 кДж теплоти; х г Al реагують з виділенням 77 кДж теплоти. Звідси
б)
381г J2 реагують з виділенням 308 кДж теплоти; y г J2 реагують з виділенням 77 кДж теплоти. Звідси Відповідь: Прореагувало 6,75 г алюмінію та 95,25 г йоду.
Приклад 2. Визначення об’єму і маси реагуючої речовини за величиною теплового ефекту реакції. Визначити об’єм (н.у.) і масу вуглекислого газу, необхідного для реакції
якщо при цьому виділяється 379,9кДж теплоти. Розв’язання. Як видно з термохімічного рівняння, при взаємодії 1 моля, тобто 22,4 л (взятих за н.у.) вуглекислого газу з лугом, виділяється 170,2 кДж теплоти. Тому можемо скласти пропорції: 22,4 л СО2 реагують з виділенням 170,2 кДж теплоти, х л СО2 реагують з виділенням 379,9 кДж теплоти. Звідси Для знаходження маси СО2 необхідно знайти молярну масу:
Відповідно до першого наслідку із закону Авогадро маса 1 моля СО2 займає об’єм 22,4 л (за н.у.). Тоді масу СО2 можна розрахувати з пропорції: 44 г СО2 займають об’єм 22,4 л y г СО2 займають об’єм 50 л. Звідси Відповідь. Прореагувало 50 л СО2 масою 98,2 г.
Приклад 3. Визначення теплового ефекту реакції за масою реагуючої речовини. Визначити кількість теплоти, яка виділяється при згорянні 10 кг амоніаку, якщо термохімічне рівняння має вигляд:
Розв’язання. Як видно з термохімічного рівняння, при згорянні 4 моль амоніаку виділяється 1168,8 кДж теплоти. Тобто ця кількість теплоти виділяється при згорянні амоніаку масою
Складаємо пропорцію: 0,068 кг NH3 згоряє з виділенням 1168,8 кДж теплоти 10 кг NH3 згоряє з виділеннямх кДж теплоти. Звідси Відповідь: При згорянні 10 кг амоніаку виділяється 171882,4 кДж теплоти.
Приклад 4. Визначення теплоти утворення складної речовини за відомим тепловим ефектом відповідної реакції. Визначити теплоту утворення цинк сульфіду, якщо при взаємодії 0,25 г сірки з надлишком цинку за стандартних умов виділилось 1,6 кДж теплоти. Записати відповідне термохімічне рівняння. Розв’язання. Під теплотою утворення ( Записуємо відповідне рівняння реакції утворення ZnS:
Як видно з рівняння, кількість молів Sі ZnS рівні: Через відому масу сірки знаходимо Оскільки Отже теплота утворення ZnS(Т) дорівнює =-205,1 кДж/моль, або Відповідь. Теплота утворення цинк сульфіду дорівнює Термохімічне рівняння має вигляд:
Приклад 5. Розрахунок стандартної теплоти утворення за законом Гесса. Розрахувати теплоту утворення метану, користуючись такими термохімічними рівняннями:
Розв’язання. Згідно до закону Гесса термохімічними рівняннями можна оперувати, як і алгебраїчними. Щоб одержати рівняння реакції утворення метану:
треба рівняння (1) помножити на 2, додати до нього рівняння (2) і від одержаної суми відняти рівняння (3). Отримуємо сумарне рівняння: 2Н2(Г) + 2Н2(Г) + С(К) → СН4(Г). Відповідні дії здійснюємо з тепловими ефектами реакцій: ΔНР = 2ΔН1 + ΔН2 – ΔН3 = 2 (-285,84) + (-393,51) – (- 890,31) = 74,88 кДж. Оскільки Відповідь:
Приклад 6. Визначення теплового ефекту реакції за стандартними теплотами утворення речовин. Визначити тепловий ефект реакції:
за відомими величинами стандартних теплот утворення речовин ( Розв’язання: Для цього використовуємо перший наслідок із законуГесса:
Значення
Відповідь: ΔНР = -198,38 кДж
КОНТРОЛЬНІ ЗАВДАННЯ 81. Визначити кількість теплоти, яка виділяється при вибуху 1 л водню та 2 л хлору (н.у.), якщо теплота утворення хлороводню становить Відповідь: 8,2 кДж.
82. Визначити кількість теплоти, яка виділяється, якщо під час реакції прореагує 60 г алюмінію:
Відповідь: 921,1 кДж. 83.Визначити об’єми (н.у.) фосфіну і кисню, необхідних для реакції
якщо при цьому виділяється 5000 кДж теплоти. Відповідь: 94,9 л; 189,8 л.
84. Визначити кількість теплоти, яка поглинається при розкладі 1 кг магній карбонату, виходячи з рівняння
Відповідь: 1207,86 кДж.
85. При взаємодії азоту з воднем з утворенням амоніаку виділилось 100 кДж теплоти. Визначити які об’єми (н.у.) газів прореагували, якщо теплота утворення газоподібного амоніаку дорівнює Відповідь: 24,2 л; 72,7 л. 86. Визначити теплоту утворення нітроген(II) оксиду, якщо при взаємодії 28 г азоту з киснем за стандартних умов поглинулося 180 кДж теплоти. Записати відповідне термохімічне рівняння. Відповідь: 87. Визначити об’єм (н.у.) і масу кисню, необхідного для реакції
якщо при цьому виділяється 500 кДж теплоти. Відповідь: 54,1 г; 37,8 л.
88. Визначити теплоту утворення сірководню, якщо при взаємодії водню з 500 г сірки виділилось 314,8 кДж теплоти. Записати термохімічне рівняння процесу.
Відповідь:
89. Визначити кількість теплоти, яка поглинається при взаємодії 80 л (н.у.) водню з ферум(III) оксидом, якщо термохімічне рівняння має вигляд:
Відповідь: 115 кДж.
90. Процес відновлення Fe2O3 воднем відбувається за рівнянням:
Визначити масу заліза, що утворилося під час цієї реакції з поглинанням 1725,2 кДж теплоти. Відповідь: 2 кг.
91. При взаємодії водню з киснем з утворенням рідкої води виділилось 1500 кДж теплоти (н.у.). Які об’єми газів прореагували? Теплота утворення рідкої води дорівнює Відповідь: 117,55 л; 58,77 л.
92. На основі термохімічного рівняння реакції
визначити масу гашеного вапна, яке утворюється при виділенні 1323,65 кДж теплоти. Відповідь: 1,5 кг
93. Визначити теплоту утворення газоподібного метану СН4(г), якщо при взаємодії з вуглецем прореагувало 40 л водню і при цьому виділилось 66,8 кДж теплоти. Записати відповідне термохімічне рівняння. Відповідь:
94. Визначити кількість теплоти, яка виділяється при утворенні 30 г кальцій силікату, виходячи з термохімічного рівняння
Відповідь: 22,66 кДж.
95. Визначити маси ферум(II) оксиду і карбон(II) оксиду, необхідні для реакції
якщо при цьому виділяється 5,5 кДж теплоти. Відповідь: 20,49 г, 7,97 г.
96. Визначити кількість теплоти, яка виділяється при утворенні 3 кг кристалогідрату цинк сульфату, виходячи з термохімічного рівняння:
Відповідь: 902,9 кДж.
97. Термохімічне рівняння згоряння бензену з утворенням рідкої води має вигляд
Визначити кількість молів кисню і бензену, при взаємодії яких виділиться 27795 кДж теплоти. Відповідь: 63,6 молів, 8,5 молів.
98. Визначити кількість грамів фосфору, який згорів у надлишку кисню, якщо при цьому виділилось 746 кДж теплоти. Відповідь: 30,97 г.
99. Визначити кількість теплоти, яка виділяється при взаємодії трьох молів алюмінію з надлишком сірки, якщо внаслідок реагування 13,49 г алюмінію виділилось 127,2 кДж теплоти. Відповідь: 763,2 кДж.
100. Визначити об’єми азоту та водню (н.у.), які прореагували з виділенням 184,8 кДж теплоти. Відповідь: 44,8 л, 134,4 л. 101. Визначити тепловий ефект реакції відновлення ферум(II) оксиду воднем, виходячи з термохімічних рівнянь:
Відповідь: 28 кДж.
102 Визначити тепловий ефект процесу перетворення графіту на алмаз, виходячи з термохімічних рівнянь:
Відповідь: 1,9 кДж.
103. Визначити теплоту утворення кальцій гідроксиду, виходячи з термохімічних рівнянь:
Відповідь: –986,50 кДж/моль.
104. Визначити тепловий ефект реакції відновлення Fe3O4(К) воднем, виходячи з термохімічних рівнянь:
Відповідь: 150,6 кДж.
105. Визначити теплоту утворення етилену С2Н4(Г), виходячи з термохімічних рівнянь:
Відповідь: 52,4 кДж/моль.
106. Визначити теплоту утворення NO(Г), виходячи з термохімічних рівнянь:
Відповідь: 90,37 кДж/моль. 107. Визначити теплоту утворення вуглекислого газу СО2(Г), виходячи з термохімічних рівнянь:
Відповідь: –393,31 кДж/моль.
108. Визначити теплоту утворення Н2О(Р), виходячи з термохімічних рівнянь:
Відповідь: –285,8 кДж/моль.
109. Визначити теплоту утворення ферум(II) оксиду FeO(К), виходячи з термохімічних рівнянь:
Відповідь: –269,82 кДж/моль.
110. Визначити теплоту утворення етану С2Н6(Г), виходячи з термохімічних рівнянь:
Відповідь: –84,67 кДж/моль.
111. Визначити теплоту утворення N2O(Г), виходячи з термохімічних рівнянь:
Відповідь: 82 кДж/моль.
112. Скільки треба витратити теплоти, щоб розкласти 200 г Na2CO3 до натрій оксиду та вуглекислого газу, якщо теплові ефекти реакцій дорівнюють:
Відповідь: 576,4 кДж.
113. Розрахувати тепловий ефект реакції утворення цинк сульфату ZnSO4(К) шляхом окиснення цинк сульфіду ZnS(К), виходячи з термохімічних рівнянь:
Відповідь: 777,3 кДж.
114. Визначити кількість теплоти, що виділяється під час взаємодії 50 г фосфорного ангідриду Р2О5(К) з водою за реакцією
якщо відомі теплові ефекти реакцій:
Відповідь: –146,41 кДж
115. Визначити стандартну теплоту утворення етилового спирту С2Н5ОН(Р), виходячи з термохімічних рівнянь:
Відповідь: –277,63 кДж/моль.
116. Визначити стандартну теплоту утворення Fe2O3(К), виходячи з термохімічних рівнянь:
Відповідь: –824 кДж/моль.
117. Визначити стандартну теплоту утворення MgCO3(К), виходячи з термохімічних рівнянь:
Відповідь: –1113 кДж/моль.
118. Розрахувати тепловий ефект реакції виходячи з термохімічних рівнянь:
Відповідь: 22,96 кДж/моль.
119. Визначити тепловий ефект реакцій горіння метану СН4(Г) з утворенням вуглекислого газу СО2(Г) та води Н2О(Г) за такими даними:
Відповідь: –802,28 кДж.
120. Визначити стандартну теплоту утворення амоніаку NH3(Г), виходячи з термохімічних рівнянь:
Відповідь: –46,19 кДж/моль. 121. Теплота утворення кальцій гідроксиду з оксидів СаО(Т) та Н2О(Р) становить –65,1 кДж/моль. Визначити стандартну теплоту утворення кальцій оксиду, виходячи з термохімічного рівняння
Відповідь: -635,6 кДж/моль.
122. Визначити тепловий ефект реакції
за відомими величинами стандартних теплот утворення вихідних речовин та продуктів реакції. Відповідь: 233,2 кДж
123. Визначити стандартну теплоту утворення фосфіну РН3, використовуючи термохімічне рівняння
якщо відомі стандартні теплоти утворення Р2О5(Т) і Н2О(Р). Відповідь: 5,3 кДж/моль.
124. Визначити тепловий ефект реакції за відомими величинами стандартних теплот утворення вихідних речовин та продуктів реакції. Відповідь: -115,5 кДж.
125. Визначити тепловий ефект реакції
за відомими величинами стандартних теплот утворення вихідних речовин та продуктів реакції. Відповідь: -853,7 кДж.
126. Визначити тепловий ефект реакції за відомими величинами стандартних теплот утворення вихідних речовин та продуктів реакції
Відповідь: -566 кДж
127. Визначити тепловий ефект реакції за відомими величинами стандартних теплот утворення вихідних речовин та продуктів реакції
Відповідь: -198 кДж
128. Знайти стандартну теплоту утворення CaSiO3(Т), використовуючи стандартні теплоти утворення SiO2(Т), СаО(Т) і тепловий ефект реакції
Відповідь: -1579,0 кДж/моль.
129. Використовуючи термохімічне рівняння
розрахувати стандартну теплоту утворення СаО, якщо відомі стандартні теплоти утворення SiO2(Т) і CaSiO3(Т). Відповідь: -635,1 кДж/моль.
130. Визначити стандартну теплоту утворення SiO2(Т), використовуючи термохімічне рівняння
якщо відомі стандартні теплоти утворення CaO(Т) і CaSiO3(Т). Відповідь: -859,3 кДж/моль.
131. Використовуючи термохімічне рівняння
розрахувати стандартну теплоту утворення СО, якщо відомі стандартні теплоти утворення Fe2O3(Т) і CO2(Г) Відповідь: -110,5 кДж/моль.
132. Використовуючи термохімічне рівняння
розрахувати стандартну теплоту утворення СО2(г), якщо відомі стандартні теплоти утворення СО(Г) і Fe2O3(Т). Відповідь: -393,51 кДж/моль
133. Використовуючи термохімічне рівняння
розрахувати стандартну теплоту утворення Fe2O3(Т), якщо відомі стандартні теплоти утворення СО(Г) і СО2(Г). Відповідь: -821,32 кДж/моль.
134. Визначити тепловий ефект гасіння вапна водою при 250С, якщо відомі величини стандартних теплот утворення вихідних речовин та продуктів реакції. Відповідь: -65,1 кДж.
135. Знайти стандартну теплоту утворення Na2CO3, використовуючи термохімічне рівняння
якщо відомі стандартні теплоти утворення SiO2(Т), Na2SiO3(Т) і СО2(Г). Відповідь: -1129,0 кДж/моль.
136. Визначити стандартну теплоту утворення NH4Cl(Т) використовуючи термохімічне рівняння
якщо відомі стандартні теплоти утворення NH3(Г) і HСl(Г). Відповідь: -315,39 кДж/моль.
137. Визначити тепловий ефект реакції розкладу MgCO3
за величинами стандартних теплот утворення MgCO3(Т), MgO(Т) і СО2(Г). Відповідь: 100,9 кДж.
138. Визначити стандартну теплоту утворення MgCO3, використовуючи термохімічне рівняння
якщо відомі стандартні теплоти утворення MgO(m) і CO2(г). Відповідь: -1096 кДж/моль.
139. Знайти тепловий ефект реакції
за відомими величинами стандартних теплот утворення вихідних речовин та продуктів реакції. Відповідь: 490,54 кДж.
140. Визначити стандартну теплоту утворення пентахлориду фосфору, використовуючи термохімічне рівняння
якщо відома стандартна теплота утворення РСl3. Відповідь: -374,9 кДж/моль.
|
|||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 1204; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.199.93 (0.008 с.) |

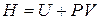 .
.
 . Розмірність – кДж.
. Розмірність – кДж.
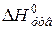
 . Розмірність – кДж/моль.
. Розмірність – кДж/моль.


 кДж/моль.
кДж/моль.
 .
. .
. = 254 г/моль;
= 254 г/моль; ,
,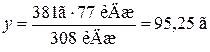 .
. кДж,
кДж, .
.
 .
. кДж
кДж
 кДж.
кДж. ) розуміють зміну ентальпії реакції утворення 1 моля складної речовини з відповідних простих речовин, взятих у стійкому при певних умовах стані. Тобто
) розуміють зміну ентальпії реакції утворення 1 моля складної речовини з відповідних простих речовин, взятих у стійкому при певних умовах стані. Тобто 
 .
. .
. .
. , то
, то  .
.
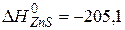 кДж/моль.
кДж/моль. кДж.
кДж.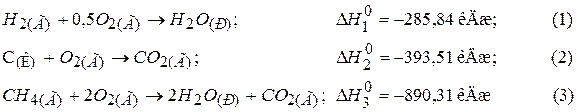

 , то
, то 
 = 74,88 кДж/моль.
= 74,88 кДж/моль.
 ).
).

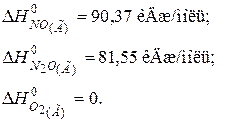

 кДж/моль.
кДж/моль. кДж
кДж кДж,
кДж, кДж.
кДж. кДж/моль.
кДж/моль. кДж/моль.
кДж/моль.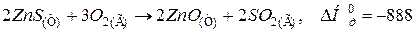 кДж,
кДж, кДж/моль.
кДж/моль.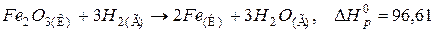 кДж.
кДж. кДж.
кДж. кДж/моль.
кДж/моль. кДж
кДж кДж/моль.
кДж/моль. кДж.
кДж. кДж,
кДж, кДж.
кДж. кДж.
кДж.








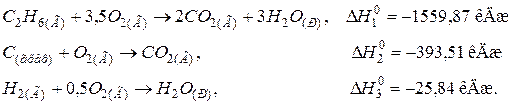



 ,
,
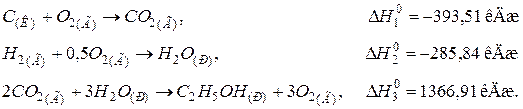


 ,
,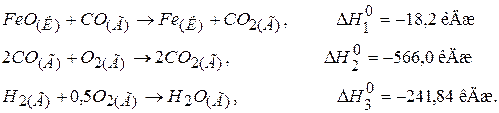




 ,
,




 ,
, ,
,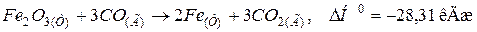 ,
, ,
,

 ,
,