
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ступінь та константа дисоціаціїСодержание книги
Поиск на нашем сайте
ОСНОВНІ ПОНЯТТЯ ТА ВИЗНАЧЕННЯ
ПРИКЛАДИ ВИКОНАННЯ ЗАВДАНЬ Приклад 1. Зв’язок між ступенем і константою дисоціації електроліту. Закон розведення Оствальда. Визначити ступінь дисоціації карбонатної кислоти в 0,1М розчині, якщо константа дисоціації кислоти за першим ступенем дорівнює 4,5·10-7. Розв’язання. Константа дисоціації і ступінь дисоціації слабкого електроліту зв’язані між собою співвідношенням (закон розведення Оствальда):
де Кдис – константа дисоціації; С – концентрація електроліту, моль/л. Для розчинів слабких електролітів, які дуже малою мірою дисоціюють на іони, ступінь електролітичної дисоціації набагато менший одиниці (α <<1). Тому рівняння розведення Оствальда можна спростити (оскільки за таких умов 1-α ≈ 1):
звідки
Карбонатна кислота дуже слабка, тому для обчислення ступеня дисоціації скористаємось спрощеним виразом закону розведення Оствальда
Відповідь: Ступінь дисоціації карбонатної кислоти дорівнює 2,1·10-3 або 0,21%.
Приклад 2. Розрахунок ізотонічного коефіцієнта за вмістом частинок розчиненого електроліту. Визначити ізотонічний коефіцієнт 0,5М розчину HCl, якщо в 1 л його міститься 5,65·1023 частинок електроліту. Розв’язання. За визначенням ізотонічний коефіцієнт показує, у скільки разів число частинок в розчині електроліту перебільшує число частинок без урахування дисоціації. Тобто
де nчаст - число молекул і іонів в розчині електроліту; nвих - число молекул електроліту, взятих для приготування розчину. Для розрахунку ізотонічного коефіцієнту необхідно визначити число молекул в 1 л 0,5 молярного розчину. Скориставшись числом Авогадро NA=6,02·1023 моль-1, знаходимо
Отже
Приклад 3. Розрахунок ступеня дисоціації електроліту за величиною ізотонічного коефіцієнта. При деякій температурі ізотонічний коефіцієнт 0,2 молярного розчину кальцій нітрату дорівнює 2,48. Розрахувати уявний ступінь дисоціації цього електроліту. Розвязання. Ступінь дисоціації і ізотонічний коефіцієнт електроліту пов’язані між собою співвідношенням
де n – число іонів, що утворюються при дисоціації молекули електроліту. При дисоціації Ca(NO3)2 утворюється 3 іона:
Уявний ступінь дисоціації цього електроліту дорівнює
Приклад 4. Визначення уявного ступеня дисоціації сильного електроліту на підставі температури замерзання розчину. Визначити уявний ступінь дисоціації ZnCl2, виходячи з того, що розчин 0,85 гZnCl2 в 125 г води замерзає при -0,230С. Розв’язання. Уявний ступінь дисоціації пов’язаний з ізотонічним коефіцієнтом і співвідношенням:
де: α – уявний ступінь дисоціації електроліту; i – ізотонічний коефіцієнт; n – кількість іонів, на які дисоціює молекула електроліту. В нашому випадку
Ізотонічний коефіцієнт i, виходячи з умов задачи, може бути розрахований як відношення
Знаходимо експериментальне зниження температури замерзання (кристалізації) розчину:
де Ткр р-ну – температура кристалізації розчину, 0С, або К.
За законом Рауля зниження температури замерзання розчину відносно чистого розчинника визначається рівнянням:
де: К – кріоскопічна стала розчинника (для води К=1,860С·кг/моль); m реч – масса розчиненої речовини, г; mр -ка – маса розчинника, кг; М – молярна маса розчиненої речовини, г/моль.
Приклад 5. Розрахунок ступеня дисоціації електроліта за осмотичним тиском його розчину. Розрахувати уявний ступінь електролітичної дисоціації LiCl в 0,1 молярному розчині, якщо його осмотичний тиск при 00С дорівнює 4,31·105Па. Розв’язання Ступінь дисоціації та ізотонічний коефіцієнт пов’язані між собою співвідношенням
де n – число іонів, що утворюються при дисоціації молекули електроліту. Величину ізотонічного коефіцієнта визначаємо за осмотичним тиском експериментальним і розрахованим за законом Вант-Гоффа
де См- молярна концентрація розчину, моль/л; R – універсальна газова стала; Т- температура, К.
Уявний ступінь дисоціації LiCl в 0,1 М розчині дорівнює:
Приклад 6. Розрахунок ізотонічного коефіцієнта і ступеня дисоціації електроліту за величиною тиску пари розчинника над розчином. Тиск водяної пари над розчином 33,3 г CaCl2 в 45 г води при 900С становить 56690 Па. Чому дорівнює ізотонічний коефіцієнт і уявний ступінь дисоціації солі, якщо тиск водяної пари за тієї самої температури становить 70101 Па? Розв’язання. Перший закон Рауля для електролітів виражається рівнянням:
де Р0 - тиск насиченої пари над розчинником, Па; P- тиск насиченої пари розчинника над розчином, Па;
Звідси ізотонічний коефіцієнт дорівнює
Знаходимо
Оскільки то Розраховуємо ізотонічний коефіцієнт:
Уявний ступінь дисоціації дорівнює де n – число іонів, що утворюються при дисоціації молекули електроліту. Для
КОНТРОЛЬНІ ЗАВДАННЯ 321. Визначити ступінь дисоціації сульфідної кислоти в 0,1 М розчині, якщо константа дисоціації за першим ступенем дорівнює 1,1·10-7. Відповідь: 1,05·10-3.
322. Визначити ступінь дисоціації ацетатної кислоти в 1М розчині, якщо константа дисоціації дорівнює 1,75·10-5 Відповідь: 4,2·10-3.
323. Визначити константу дисоціації ацетатної кислоти в 0,1 М розчині, якщо ступінь дисоціації дорівнює 1,34%. Відповідь: 1,79·10-5.
324. Визначити ступінь дисоціації купрум(II) гідроксиду в 0,1 М розчині, якщо константа дисоціації дорівнює 3,4·10-7. Відповідь: 0,18%.
325. Визначити константу дисоціації алюміній гідроксиду в 0,1М розчині, якщо ступінь дисоціації дорівнює 1,33%. Відповідь: 1,77·10-5.
326. Знайти константу дисоціації сульфідної кислоти в 0,1 М розчині, якщо ступінь дисоціації дорівнює 0,105%. Відповідь: 1,1·10-7.
327. Розрахувати ступінь дисоціації купрум(II) гідроксиду в 0,01 М розчині, якщо константа дисоціації дорівнює 3,4·10-7. Відповідь: 0,58%.
328. Знайти константу дисоціації нітритної кислоти в 0,01 М розчині, якщо ступінь дисоціації дорівнює 0,22. Відповідь: 4,84·10-4
329. Розрахувати ступінь дисоціації сульфідної кислоти в 0,1 М розчині, якщо константа дисоціації дорівнює 1,1·10-7. Відповідь: 0,105%.
330. Розрахувати ступінь дисоціації нітритної кислоти в 0,01 М розчині, якщо константа дисоціації дорівнює 5,1·10-4. Відповідь: 22,6%.
331. Знайти константу дисоціації ацетатної кислоти в 0,01 М розчині, якщо ступінь дисоціації дорівнює 4,25%. Відповідь: 1,81·10-5.
332. Знайти константу дисоціації ацетатної кислоти в 1М розчині, якщо ступінь дисоціації дорівнює 0,42. Відповідь: 1,76·10-5.
333. Визначити ступінь дисоціації фторидної кислоти в 0,1 М розчині, якщо константа дисоціації дорівнює 7,4·10-4. Відповідь: 8,23%.
334. Визначити ступінь дисоціації мурашиної кислоти НСООН в 0,1 М розчині, якщо константа дисоціації дорівнює 1,8·10-4. Відповідь: 4,2%.
335. Визначити ступінь дисоціації ціанідної кислоти в 0,05 М розчині, якщо константа дисоціації дорівнює 7,9·10-10. Відповідь: 0,013%.
336. Визначити ступінь дисоціації хлорнуватистої кислоти HClO в 0,001 М розчині, якщо константа дисоціації дорівнює 5,0·10-8. Відповідь: 0,07%.
337. Визначити ступінь дисоціації нітритної кислоти в 0,02 М розчині, якщо константа дисоціації дорівнює 4·10-4. Відповідь: 15,8%.
338. Знайти константу дисоціації мурашиної кислоти в 0,2 М розчині, якщо ступінь дисоціації НСООН дорівнює 3,2%. Відповідь: 2·10-4.
339. Знайти константу дисоціації HClO в 0,1 М розчині, якщо ступінь дисоціації кислоти дорівнює 0,07%. Відповідь: 4,9·10-8.
340. Знайти константу дисоціації карбонатної кислоти в 0,15 М розчині, якщо ступінь дисоціації Н2СО3 дорівнює 0,173%. Відповідь: 4,5·10-7.
341. Визначити ізотонічний коефіцієнт розчину ацетатної кислоти і ступінь її дисоціації, якщо в 1 л 0,01М розчину міститься 6,26·1021 молекул і іонів цієї кислоти. Відповідь: 1,04, 4%.
342. Визначити уявний ступінь дисоціації HNO3, якщо розчин 0,25 моль HNO3 в 2,5 л води замерзає при -0,350С. Відповідь: 89%.
343. Осмотичний тиск 0,05 молярного розчину калій карбонату при 00С дорівнює 136,3 кПа. Визначити уявний ступінь дисоціації Відповідь: 70%.
344. Розчин KNO3 з процентною концентрацією 8,43% закипає при 100,80С. Ебуліоскопічна стала води Е = 0,520С·кг/моль. Обчислити уявний ступінь дисоціації KNO3 в розчині. Відповідь: 69%
345. При 1000С тиск пари над розчином, що містить 0,05 моль Відповідь: 80%.
346. Розчин 0,53 г Na2CO3 в 200 г води замерзає при -0,130С. Визначити уявний ступінь дисоціації солі. Відповідь: 90%
347. Ізотонічний коефіцієнт 1 молярного розчину Відповідь: 6,2·1020. 348. Визначити ізотонічний коефіцієнт розчину, який замерзає при -0,5190С і складається з 2,1 г КОН і 250 г води. Відповідь: 1,86 349. Розрахувати відносне зниження тиску водяної пари при деякій температурі над розчином, що складається з 7,1 г Na2SO4 і 500 г води. Уявний ступінь дисоціації Відповідь: 4,5·10-3.
350. Обчислити ізотонічний коефіцієнт для 2н розчину CaCl2, що має при 200С осмотичний тиск 5600 кПа. Визначити уявний ступінь дисоціації CaCl2 в цьому розчині. Відповідь: 2,3; 65%.
351. Визначити ступінь дисоціації фторидної кислоти, якщо при розчиненні 0,1 моль HF в 1 л води утворюється 1,81·1022 іонів і 5,12·1022 молекул цієї кислоти. Відповідь: 15%.
352. Визначити осмотичний тиск розчину MgSO4 з молярною концентрацією 0,1 моль/л, якщо уявний ступінь дисоціації солі дорівнює 0,5. Відповідь: 187 кПа.
353. Тиск водяної пари над розчином 22,2 г CaCl2 в 1000 г води при 200С становить 2,32 кПа, а тиск пари над водою за тієї самої температури – 2,34 кПа. Визначити уявний ступінь дисоціації солі в розчині. Відповідь: 69,5%.
354. При розчиненні NaOH масою 12 г в 100 г води температура кипіння підвищилась на 2,650С. Ебуліоскопічна стала води Е=0,520С·кг/моль. Визначити уявний ступінь дисоціації NaOH. Відповідь: 70%.
355. Чому дорівнює осмотичний тиск 0,1 молярного розчину KCl при 170С, якщо уявний ступінь дисоціації цієї солі становить 85%? Відповідь: 445,8 кПа.
356. Обчислити ізотонічний коефіцієнт розчину MgCl2, якщо уявний ступінь дисоціації солі складає 75%. Відповідь: 2,5.
357. Визначити уявний ступінь дисоціації CaCl2 в розчині, який містить 4,47г CaCl2 в 100 г води, і замерзає при -20С. Відповідь: 80%.
358. Обчислити тиск пари при 1000С над розчином, який складається з 24,8 г КСl і 100 г води. Уявний ступінь дисоціації солі дорівнює 75%. Відповідь: 91,7 кПа.
359. Визначити уявний ступінь дисоціації NH4Cl, якщо для приготування розчину взяли сіль масою 1,07 г і воду об’ємом 200 мл. Температура кипіння цього розчину дорівнює 100,090С. Відповідь: 73%.
360.Обчислити ізотонічний коефіцієнт розчину ZnSO4 з молярною концентрацією 0,1 моль/л, якщо уявний ступінь дисоціації складає 40%. Відповідь: 1,4
ІОННИЙ ДОБУТОК ВОДИ. ВОДНЕВИЙ ПОКАЗНИК
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 2038; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.91.59 (0.008 с.) |

 або
або  .
.
 .
.
 .
.
 .
.
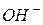 .
.
 ,
де
,
де  - рівноважні концентрації іонів та недисоційованих молекул слабкого електроліту.
- рівноважні концентрації іонів та недисоційованих молекул слабкого електроліту.
 або
або 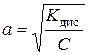
 .
.

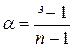
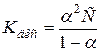
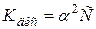 ,
, .
. .
.
 .
.
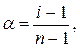
 .
. або 74%.
або 74%. ,
, .
. (кристалізації), знайдене дослідним шляхом, до тієї самої величини, обчисленої без урахування дисоціації електроліту (
(кристалізації), знайдене дослідним шляхом, до тієї самої величини, обчисленої без урахування дисоціації електроліту (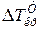 ):
): .
. ,
, - температура замерзання чистої води, 0С або К;
- температура замерзання чистої води, 0С або К; .
.
 ,
, - зниження температури замерзання розчину, 0С, або К;
- зниження температури замерзання розчину, 0С, або К; =136,4 г/моль,
=136,4 г/моль, ,
, ,
, .
.



 і
і  - кількість молів розчиненої речовини і розчинника відповідно, моль.
- кількість молів розчиненої речовини і розчинника відповідно, моль. .
. і
і  за формулою
за формулою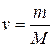 .
. ,
,  ,
, ,
, 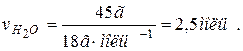

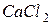 n = 3,
n = 3, , або 39%.
, або 39%. в розчині.
в розчині. в 450г води, дорівнює 100,78 кПа. Визначити уявний ступінь дисоціації
в 450г води, дорівнює 100,78 кПа. Визначити уявний ступінь дисоціації  дорівнює 1,03. Скільки розчинених частинок міститься в 10-3 л цього розчину.
дорівнює 1,03. Скільки розчинених частинок міститься в 10-3 л цього розчину. в цьому розчині дорівнює 75%.
в цьому розчині дорівнює 75%.


