Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ентропія, енергія гіббса та напрямленість процесівСодержание книги
Поиск на нашем сайте
ОСНОВНІ ПОНЯТТЯ ТА ВИЗНАЧЕННЯ
ПРИКЛАДИ ВИКОНАННЯ ЗАВДАНЬ
При виконанні завдань цього розділу див табл. 5.
Приклад 1. Залежність ентропії від агрегатного стану речовин. Як зміниться ентропія при перетвореннях: а) води в пару; б) води в лід; в) Чому? Відповідь. а) Перехід Н2О(р) → Н2О(г) супроводжується збільшенням невпорядкованості системи і тому зростанням ентропії S2 > S1. Оскільки б) Перехід супроводжується збільшенням впорядкованості системи і тому зменшенням ентропії S2 < S1. Оскільки ΔS = S2 – S1, то ΔS < 0. в) Перехід
Приклад 2. Визначення можливості перебігу процесу за величиною зміни вільної енергії Гіббса. Визначити можливість перебігу реакції
якщо відомі Розв’язання. Зміна вільної енергії Гіббса
де n і m – кількість молів певної речовини, моль;
Для даної реакції
Оскільки
Приклад 3. Визначення стандартної енергії Гіббса утворення речовини за відомою величиною зміни енергії Гіббса реакції. Відновлення заліза з його оксиду за допомогою СО відбувається за рівнянням:
Розрахувати Розв’язання. Зв’язок між
де n і m – числа молів кожної з речовин в рівнянні реакції, моль;
Для даної реакції
Звідси визначаємо
У табл.4 є значення всіх ізобарно-ізотермічних потенціалів для даної задачі:
Приклад 4. Визначення температури встановлення рівноваги в системі за термодинамічними параметрами. Визначити, за якої температури настане рівновага в системі
За якої температури рівновага системи зміститься вправо? Розв’язання. Термодинамічною умовою рівноваги є рівність
Оскільки умовою рівноваги є Починаючи з цієї температури можливий самочинний перебіг реакції. Використовуючи перший наслідок із закону Гесса, знаходимо
Отже, при Т=983,6 К - в системі встановиться рівновага, тобто однаково ймовірні прямий та зворотний напрямки реакцій. При температурах, що перевищують 983,6 К, рівновага зміщуватиметься вправо, тобто відбуватиметься пряма реакція, а при температурах нижче 983,6 К рівновага зміститься вліво, відбуватиметься зворотна реакція.
КОНТРОЛЬНІ ЗАВДАННЯ Не виконуючи розрахунків, встановити знак ΔS наступних процесів:
141.
142.
143.
144.
145.
146.
147.
148.
149.
150.
151.
152.
153.
154.
155.
156.
157.
158.
159.
160.
161. Зробити висновок про можливість самочинного перебігу реакції за стандартних умов
Відповідь обґрунтувати розрахунком Відповідь: – 959,5 кДж. 162. За якої температури настане рівновага в системі Відповідь: 325 К.
163. Визначити
Відповідь: –1076,0 кДж/моль.
164. При якій температурі настане рівновага в системі Відповідь: 385,5 К.
165. Визначити зміну стандартної енергії Гіббса реакції окиснення етилового спирту
Зробити висновок про можливість самочинного перебігу реакції за стандартних умов. Відповідь: –1326,5 кДж.
166. При якій температурі однаково ймовірні прямий та зворотний напрямки реакції
Відповідь: 882,3 К.
167. Визначити
Відповідь: 68,12 кДж/моль.
168. За якої температури настає рівновага в системі
Відповідь: 884,5 К.
169. В якому напрямку відбувається оборотна реакція
за стандартних умов? Відповідь обґрунтувати розрахунком Відповідь: 130,22 кДж.
170. За якої температури настане рівновага в системі
Відповідь: 389,2 К.
171. Визначити
Відповідь: –137,27 кДж/моль.
172. Реакція відновлення FeO відбувається за рівнянням
При якій температурі почнеться відновлення FeO.? Відповідь: понад 867,9 К.
173. Визначити
Відповідь: –33,02 кДж/моль. 174. При якій температурі настане рівновага в системі
Відповідь: 466,8 К. 175. Зробити висновок про можливість самочинного перебігу реакції відновлення Fe3O4 воднем:
Відповідь обґрунтувати розрахунком Відповідь: 99,6 кДж. 176. Визначити, при якій температурі можливий перебіг реакції
Відповідь: 6445,1 К.
177. Виходячи з рівняння реакції
визначити Відповідь: –1014,8 кДж/моль.
178. При якій температурі однаково ймовірні прямий та зворотний напрямки реакції
Відповідь: 965,5 К.
179. В якому напрямку проходить оборотна реакція згоряння хлороводню
за стандартних умов? Відповідь обґрунтувати розрахунком Відповідь: -79,6 кДж.
180. При якій температурі стає термодинамічно можливою реакція відновлення титан(IV) оксиду до вільного металу за рівнянням:
Відповідь: 1987,6 К.
ХІМІЧНА КІНЕТИКА
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 1167; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.126.199 (0.009 с.) |

 . Розмірність ентропії Дж/(моль·К).
. Розмірність ентропії Дж/(моль·К).

 .
.

 , то Δ S > 0
, то Δ S > 0
 супроводжується збільшенням невпорядкованості системи, тому що утворюється газоподібна речовина СО2. Ентропія системи збільшується, тобто S2 > S1 і ΔS > 0.
супроводжується збільшенням невпорядкованості системи, тому що утворюється газоподібна речовина СО2. Ентропія системи збільшується, тобто S2 > S1 і ΔS > 0.
 утворення (стандартна вільна енергія Гіббса або ізобарно-ізотермічний потенціал) усіх речовин:
утворення (стандартна вільна енергія Гіббса або ізобарно-ізотермічний потенціал) усіх речовин:  кДж/моль;
кДж/моль;  кДж/моль;
кДж/моль;  кДж/моль;
кДж/моль;  кДж/моль. Відповідь обґрунтувати розрахунком
кДж/моль. Відповідь обґрунтувати розрахунком  ,
, і
і  - стандартні вільні енергії Гіббса утворення продуктів реакції і вихідних речовин відповідно, кДж/моль.
- стандартні вільні енергії Гіббса утворення продуктів реакції і вихідних речовин відповідно, кДж/моль.


 , то реакція можлива.
, то реакція можлива.
 і
і  ,
, і
і  - стандартні вільні енергії Гіббса утворення продуктів реакції і вихідних речовин відповідно, кДж/моль.
- стандартні вільні енергії Гіббса утворення продуктів реакції і вихідних речовин відповідно, кДж/моль. .
. :
: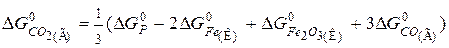 .
. кДж/моль;
кДж/моль;  кДж/моль;
кДж/моль; кДж/моль. Отже
кДж/моль. Отже (кДж/моль).
(кДж/моль).
 . Знаходимо температуру, за якої встановиться рівновага в системі, із співвідношення
. Знаходимо температуру, за якої встановиться рівновага в системі, із співвідношення
 , то і
, то і  . Тоді
. Тоді  і
і  .
. і
і  за рівняннями
за рівняннями  і
і  , підставивши взяті з таблиць теплоти утворення і ентропії компонентів реакції:
, підставивши взяті з таблиць теплоти утворення і ентропії компонентів реакції:

 .
.

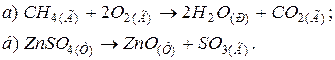

















 .
.
 на підставі
на підставі 

 .
.

 кДж?
кДж?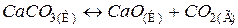
 кДж?
кДж?