
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ое начало термодинамики и его применение к различным процессам.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Количество теплоты, сообщенное термодинамической системе, расходуется на изменение ее внутренней энергии и на совершение работы системой против внешних сил. Если вместо работы A системы над внешними телами ввести работу внешних сил A ' (А = –A '), то первое начало термодинамики можно переписать так: ΔU=Q+A Изменение внутренней энергии термодинамической системы равно сумме работы, произведенной над системой внешними силами, и количеству теплоты, переданному системе в процессе теплообмена. Первое начало термодинамики является обобщением закона сохранения энергии для механических и тепловых процессов. Например, рассмотрим процесс торможения бруска на горизонтальной поверхности под действием силы трения. Скорость бруска уменьшается, механическая энергия «исчезает». Но при этом трущиеся поверхности (брусок и горизонтальная поверхность) нагреваются, т.е. механическая энергия превращается во внутреннюю. Применение первого начала к различным тепловым процессам Изохорный процесс Объем не изменяется: V = const. Следовательно, ΔV = 0 и А = –A ' = 0, т.е. никакой механической работа не совершается. Первое начало термодинамики будет иметь вид: Q=ΔU. При изохорном процессе вся энергия, сообщаемая газу путем теплообмена, расходуется целиком на увеличение его внутренней энергии. Изотермический процесс Температура газа не изменяется: Τ = const. Следовательно, ΔT = 0 и ΔU = 0. Первое начало термодинамики будет имеет вид: Q=A. При изотермическом процессе вся энергия, сообщаемая газу путем теплообмена, идет на совершение газом работы. Изобарный процесс Давление не изменяется: p = const. При расширении газ совершает работу Α = p⋅ΔV и нагревается, т.е. изменяется его внутренняя энергия. Первое начало термодинамики будет имеет вид: Q=A+ΔU. При изобарном процессе количество теплоты, сообщенное термодинамической системе, расходуется на изменение ее внутренней энергии и на совершение работы системой против внешних сил. Адиабатный процесс Это процесс, в котором теплообмен с окружающей средой не происходит, т.е. Q=0 0=ΔU+A ΔU=-A или ΔU=A’
45. Теплоемкость.Уравнение Майера. Недостатки классической теории теплоемкости. Количество тепла, при получении которого температура тела повышается на один градус, называется теплоемкостью. Согласно этому определению
Теплоемкость различается в зависимости от того, при каких условиях происходит нагревание тела — при постоянном объеме или при постоянном давлении. Если нагревание тела происходит при постоянном объеме, т. е. dV = 0, то работа равна нулю. В этом случае передаваемое телу тепло идет только на изменение его внутренней энергии, dQ = dE, и в этом случае теплоемкость равна изменению внутренней энергии при изменении температуры на 1 К, т. е.
Поскольку для газа Эта формула определяет теплоемкость 1 моля идеального газа, называемую молярной. При нагревании газа при постоянном давлении его объем меняется, сообщенное телу тепло идет не только на увеличение его внутренней энергии, но и на совершение работы, т.е. dQ = dE + PdV. Теплоемкость при постоянном давлении Для идеального газа PV = RT и поэтому PdV = RdT. Учитывая это, найдем
Отношение
Уравнение Майера: Cp=Cv+R. R-газовая постоянная. Ср в процессе с постоянным давлением всегда больше теплоемкости Cv в.
46. Адиабатный процесс. Уравнение адиабаты. Адиабатный процесс — это процесс, происходящий без теплообмена системы с окружающей средой, т.е. Q = 0. Такие процессы происходят при хорошей теплоизоляции системы либо при быстрых процессах, когда теплообмен практически не успевает произойти. Первое начало термодинамики будет имеет вид: ΔU+A=0 или A=−ΔU. Если А > 0 (ΔV > 0 газ расширяется), то ΔU < 0 (газ охлаждается), т.е. при адиабатном расширении газ совершает работу и сам охлаждается. Охлаждение воздуха при адиабатном расширении вызывает, например, образование облаков. Если А < 0 (ΔV < 0 газ сжимается), то ΔU > 0 (газ нагревается), т.е. при адиабатном сжатии над газом совершается работа и газ нагревается. Это используется, например, в дизельных двигателях, где при резком сжатии воздуха температура повышается настолько, что воспламеняются пары топлива в двигателе.
PV^ γ=const TV^(γ-1)= const
47.
|
||
|
Последнее изменение этой страницы: 2016-04-06; просмотров: 845; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.008 с.) |

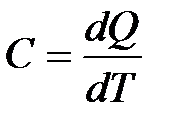 . (2.33)
. (2.33) . (2.34)
. (2.34) , то
, то  .
. .
. . (2.36)
. (2.36) представляет собой величину, характерную для каждого газа и определяемую числом степеней свободы молекул газа. Измерение теплоемкости тела есть, таким образом, способ непосредственного измерения микроскопических характеристик составляющих его молекул.
представляет собой величину, характерную для каждого газа и определяемую числом степеней свободы молекул газа. Измерение теплоемкости тела есть, таким образом, способ непосредственного измерения микроскопических характеристик составляющих его молекул.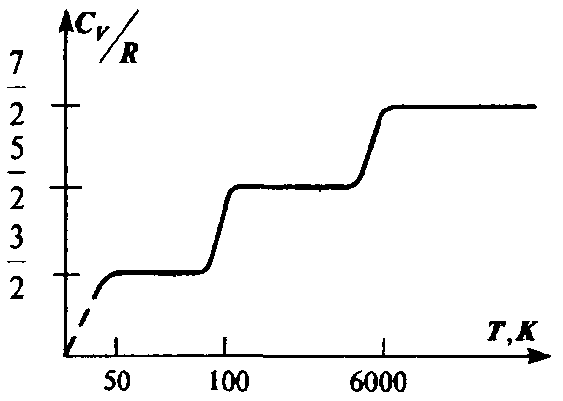 Формулы для теплоемкости идеального газа приблизительно верно описывают эксперимент, причем, в основном, для одноатомных газов. Согласно формулам, полученным выше, теплоемкость не должна зависеть от температуры. На самом деле наблюдается картина, изображенная на рис., полученная опытным путем для двухатомного газа водорода. На участке 1 газ ведет себя как система частиц, обладающих лишь поступательными степенями свободы, на участке 2 возбуждается движение, связанное с вращательными степенями свободы и, наконец, на участке 3 появляются две колебательные степени свободы. Ступеньки на кривой хорошо согласуются с формулой (2.35), однако между ними теплоемкость растет с температурой, что соответствует как бы нецелому переменному числу степеней свободы. Такое поведение теплоемкости указывает на недостаточность используемого нами представления об идеальном газе для описания реальных свойств вещества.
Формулы для теплоемкости идеального газа приблизительно верно описывают эксперимент, причем, в основном, для одноатомных газов. Согласно формулам, полученным выше, теплоемкость не должна зависеть от температуры. На самом деле наблюдается картина, изображенная на рис., полученная опытным путем для двухатомного газа водорода. На участке 1 газ ведет себя как система частиц, обладающих лишь поступательными степенями свободы, на участке 2 возбуждается движение, связанное с вращательными степенями свободы и, наконец, на участке 3 появляются две колебательные степени свободы. Ступеньки на кривой хорошо согласуются с формулой (2.35), однако между ними теплоемкость растет с температурой, что соответствует как бы нецелому переменному числу степеней свободы. Такое поведение теплоемкости указывает на недостаточность используемого нами представления об идеальном газе для описания реальных свойств вещества. Уравнение адиабаты
Уравнение адиабаты


