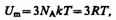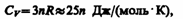Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение кристаллов. Точечные дефекты в кристаллах. Краевые и винтовые дислокации.Содержание книги
Поиск на нашем сайте
СТРОЕНИЕ КРИСТАЛЛА, упорядоченное расположение атомов, соединенных ХИМИЧЕСКИМИ СВЯЗЯМИ, многократное повторяемое. За счет этой упорядоченности, иногда асимметричной, физические свойства кристалла, такие как проводимость и прочность, закономерным образом изменяются в зависимости от того, по какой оси их измеряют. В этом отношении одиночные кристаллы (монокристаллы) отличаются от некристаллических (аморфных) и поликристаллических веществ, у которых физические свойства остаются неизменными (из-за полного смешения) либо меняются нерегулярным образом. Нульмерные (точечные) дефекты К нульмерным (или точечным) дефектам кристалла относят все дефекты, которые связаны со смещением или заменой небольшой группы атомов (собственные точечные дефекты), а также с примесями. Они возникают при нагреве, легировании, в процессе роста кристалла и в результате радиационного облучения. Могут вноситься также в результате имплантации. Свойства таких дефектов и механизмы их образования наиболее изучены, включая движение, взаимодействие, аннигиляцию, испарение. Вакансия — свободный, незанятый атомом, узел кристаллической решетки. Собственный межузельный атом — атом основного элемента, находящийся в междоузельном положении элементарной ячейки. Примесный атом замещения — замена атома одного типа, атомом другого типа в узле кристаллической решетки. В позициях замещения могут находиться атомы, которые по своим размерам и электронным свойствам относительно слабо отличаются от атомов основы. Примесный атом внедрения — атом примеси располагается в междоузлии кристаллической решетки. В металлах примесями внедрения обычно являются водород, углерод, азот и кислород. В полупроводниках — это примеси, создающие глубокие энергетические уровни в запрещенной зоне, например, медь и золото в кремнии. Дислока́ция — линейный дефект, или нарушение, кристаллической решётки твёрдого тела. Наличие дислокаций существенно влияет на механические и другие физические свойства твердого тела. Выделяют два основных типа дислокаций: краевые и винтовые. Дислокации смешанного типа являются комбинацией указанных двух типов.
Образование краевой дислокации можно представить как результат удаления одной полуплоскости из кристаллической решетки в середине кристалла. В этом случае окружающие дефект плоскости уже не будут прямыми, однако они будут огибать границу уничтоженной полуплоскости так, что на гранях кристалла структура решетки не будет нарушена и дефект не будет виден. Линия, отделяющая дефектную область кристалла от бездефектной, называется линией дислокации. Простейшая наглядная модель краевой дислокации — книга, у которой от одной из внутренних страниц оторвана часть. Тогда, если страницы книги уподобить атомным плоскостям, то край оторванной части страницы моделирует линию дислокации.
64. Теплоемкость твердых тел. В качестве модели твердого тела рассмотрим правильно построенную кристаллическую решетку, в узлах которой частицы (атомы, ионы, молекулы), принимаемые за материальные точки, колеблются около своих положений равновесия — узлов решетки — в трех взаимно перпендикулярных направлениях. Таким образом, каждой составляющей кристаллическую решетку частице приписывается три колебательных степени свободы, каждая из которых, согласно закону равнораспределения энергии по степеням свободы, обладает энергией kT. Внутренняя энергия моля твердого тела
где NA — постоянная Авогадро; NAk=R (R — молярная газовая постоянная). Молярная теплоемкость твердого тела
т. е. молярная (атомная) теплоемкость химически простых тел в кристаллическом состоянии одинакова (равна 3R) и не зависит от температуры. Этот закон был эмпирически получен французскими учеными П. Дюлонгом (1785—1838) и Л. Пти (1791—1820) и носит название закона Дюлонга и Пти. Если твердое тело является химическим соединением (например, NaCl), то число частиц в моле не равно постоянной Авогадро, а равно nNA, где n — число атомов в молекуле (для NaCl число частиц в моле равно 2NA, так, в одном моле NaCl содержится NA атомов Na и NA атомов Cl). Таким образом, молярная теплоемкость твердых химических соединений
т. е. равна сумме атомных теплоемкостей элементов, составляющих это соединение.
|
||||
|
Последнее изменение этой страницы: 2016-04-06; просмотров: 614; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.10.207 (0.006 с.) |