
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: основные уравнения термодинамикиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Первый закон термодинамики (если выполняется единственный вид работы – работа изменения объема):
d Q = d U + p d V
где Q – теплота, U – внутренняя энергия, р – давление, V – объем. Для частных случаев изохорного и изобарного процессов этот закон имеет вид:
d Q = C Vd T (при V = const), d Q = Cp d T (при p = const)
где CV = (¶ U /¶ T) V (изохорная теплоемкость), Cр = (¶ Н /¶ T) р (изобарная теплоемкость), Н = U + pV (энтальпия). Стандартная энтальпия реакции: D H ° = S n i D f H ° i, где D f H ° i – стандартная энтальпия образования i -ого партнера реакции, n i – стехиометрический коэффициент i -ого партнера реакции (положительный у продуктов, отрицательный у исходных веществ). Например, для реакции a A + b B + … = z Z + y Y + …:
То же через стандартные энтальпии сгорания: D H ° = –S n i D С H ° i , где D С H ° i – стандартная энтальпия сгорания i -ого партнера реакции. Приблизительное вычисление энтальпии образования вещества с помощью средних энтальпий химических связей D Н связь : D f H ° = Sn k D Н связь, (суммирование распространяется по всем связям k в молекулах, k – число связей данного вида в молекуле, положительное для образующейся молекулы и отрицательное для исходных простых веществ). Зависимость теплоты реакции от температуры (уравнения Кирхгофа):
Второй закон термодинамики: d S ³ d Q / T
Зависимость энтропии от температуры в обратимом процессе:
Стандартная энтропия реакции: D S ° = Sn iS ° i, где S ° i – стандартная энтропия i -ого партнера реакции. Стандартная энергия Гиббса реакции: D G ° = D H ° – T D S ° или D G ° = S n i D f G ° i , где D f G ° i – стандартная энергия Гиббса образования i -ого партнера реакции. Уравнение состояния идеального газа: pV = nRT Соотношение между стандартной энтальпией реакции D H ° и стандартной энергией реакции D U °: D H ° = D U ° + RT Sn j, j – только газообразные участники реакции. Соотношение между общим давлением газовой смеси и парциальными давлениями компонент (закон Дальтона): p = S pi
Тема: химическое равновесие
Константа равновесия (стандартная или термодинамическая константа равновесия, K или K °): K = exp Связь константы равновесия с активностями партнеров реакции aA + bB + … ƒ zZ + yY + … при равновесии:
Связь активности аi или фугитивности fi с Ci или pi:
аi = g iСi / Сi °; fi = g ipi / pi °
где С ° и р ° - концентрация и давление в стандартном состоянии, g i - коэффициент активности или фугитивности. Зависимость константы равновесия от температуры (уравнения изобары и изохоры химической реакции):
Константа равновесия aA + bB + … ƒ zZ + yY + … на основе парциальных давлений: То же, на основе концентраций: То же, на основе мольных долей: Связь константы равновесия с практическими константами КХ, КР, КС для идеальных газов и идеальных растворов:
K = KX , K = KP ×(p °)
где Sn - алгебраическая сумма стехиометрических коэффициентов. Энергия Гиббса реакции (сродство реакции) aA + bB + … = zZ + yY + … в идеальных газах или идеальных растворах (изотерма химической реакции): D G = D G ° + RT ln или D G = D G ° + RT ln
Тема: фазовые равновесия
Теплота фазового перехода: D H = D S / T, D S – энтропия фазового перехода. Зависимость между давлением и температурой при фазовом переходе (уравнение Клапейрона):
где D Н молярная теплота фазового перехода, D V – изменение молярного объёма вещества при фазовом переходе. Аналогичная зависимость для испарения и сублимации в приближении идеальности пара (уравнение Клаузиуса-Клапейрона):
|
|||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 465; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.83.189 (0.01 с.) |


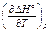 = Sn iСр i,
= Sn iСр i,  = Sn iСV i,
= Sn iСV i, = СР;
= СР;  = СV
= СV или ln K = –D G °/ RT.
или ln K = –D G °/ RT.
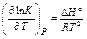 ;
; 
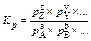


 , K = KC ×(C °)
, K = KC ×(C °)  , или D G = D G ° + RT ln
, или D G = D G ° + RT ln  ,
,





