
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: строение вещества и спектроскопияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Молярная поляризация диэлектрика (определение):
Связь молярной поляризации с поляризуемостью a неполярных молекул диэлектрика (уравнение Клаузиуса-Мосотти):
Связь молярной поляризации с деформационной поляризуемостью a0 и ориентационной поляризуемостью am полярных молекул (уравнение Дебая):
Молярная рефракция (определение)
Энергия вращения молекулы на j -том вращательном уровне:
E kin = Bj (j + 1)
где В – вращательная постоянная. Момент инерции двухатомной молекулы
I = m× ℓ 2
где ℓ - межъядерное расстояние, m - приведённая масса молекулы m = m 1 m 2/(m 1 + m 2), m 1 и m 2 – массы атомов. Энергия гармонических колебаний двухатомной молекулы на v –ом колебательном уровне: Ev = h n0(v + ½) где n0 - частота собственных колебаний, x e - коэффициент ангармоничности. То же, с учетом ангармоничности колебаний:
Ev = h n0(v + ½)[1 – x e(v + ½)]
Молярная энергия диссоциации двухатомной молекулы:
Приложение 3. Построение графиков
Практика работы с графиками требует точного знания некоторых общих положений и определений математики, которые перечислены ниже в качестве напоминания. 1. Положение любой точки на плоскости может быть определено, если введена система двух координат, относительно которых положение определяется. Наиболее распространённой является прямоугольная система координат. Такая система состоит из двух ортогональных осей, то есть двух взаимно-перпенди-кулярных прямых линий, с нанесёнными на них шкалами (см. рис. 3.1 как пример). Положение точки определяется двумя числами: - расстоянием точки от нуля горизонтальной оси – это расстояние отсчитывается по шкале данной оси и называется абсциссой точки, - расстоянием точки от нуля вертикальной оси – это расстояние отсчитывается по шкале соответствующей оси и называется ординатой точки. Эти два числа образуют упорядоченную пару, обозначаемую в общем случае (х, у) и называемую координатами точки. Слово "упорядоченная пара" означает, что координаты всегда даются в последовательности (х, у) и никогда (у, х). 2. Геометрическим местом точек на плоскости называется совокупность точек, удовлетворяющих данному условию. Данным условием обычно является некоторое алгебраическое условие. Например, геометрическим местом точек, удалённых на расстояние r от данной точки, называется окружность с центром в данной точке и с радиусом r. 3. Графиком функции у = ¦(х) называется геометрическое место точек данной функции, нанесённых на плоскость с координатными осями х и у.
 Практически график изображается непрерывной линией, называемой кривой (прямая линия рассматривается как частный случай кривой). В точном соответствии с определением графика, кривая должна быть представлена множеством точек, координаты которых удовлетворяют данному условию у = ¦(х), и которые сливаются в непрерывную линию. Например, если даны координаты центра окружности, то геометрическое место точек окружности можно изобразить с помощью циркуля. Практически график изображается непрерывной линией, называемой кривой (прямая линия рассматривается как частный случай кривой). В точном соответствии с определением графика, кривая должна быть представлена множеством точек, координаты которых удовлетворяют данному условию у = ¦(х), и которые сливаются в непрерывную линию. Например, если даны координаты центра окружности, то геометрическое место точек окружности можно изобразить с помощью циркуля.
4. Любая функция одной переменной может быть представлена графиком и, наоборот, любой график может быть представлен аналитическим выражением некоторой функции. То есть, аналитическое выражение функции у = ¦(х) и график этой функции являются эквивалентными способами определения функции. В связи с последним свойством, на практике встречаются два вида задач. В одном из них требуется построить график функции, которая по условию задачи дана в виде аналитического выражения у = ¦(х). В другом случае, дан график или, на самом деле, координаты ряда точек для графика, на основании которых требуется найти аналитическое выражение функции. Иными словами, в одном случае требуется найти геометрическое место точек данной функции, а в другом – найти функцию данного геометрического места точек. В физической химии широко применяются оба вида задач. В учебных пособиях и на аудиторной доске во время лекций обычно встречаются графики первого вида, то есть графики известной функции. Студенты могут использовать такие графики в самостоятельной работе и в ответах на теоретические вопросы. Цель этих графиков – исследовать или показать наглядно основные свойства функции. В чистой математике функции исследуются в самом общем, абстрактном виде, во всей области определения независимой переменной х. В прикладных науках аналогичные задачи отличаются некоторыми особенностями. Во-первых, обычно рассматривается поведение функции только в ограниченном интервале х, представляющем интерес в данной задаче. Во-вторых, роль переменных х и у выполняют физические величины, имеющие определённую размерность. Поэтому при построении графиков приходится решать, какие интервалы изменения х и у и какие масштабы шкал координат следует выбрать для построения графика. (Масштаб шкалы – количество единиц измерения данной физической величины, содержащееся в единице длины оси). Кроме того, единицы измерения откладываемых физических величин должны быть учтены, они должны быть указаны у каждой оси. Рассмотрим эти особенности на следующем примере.
Hg2Cl2 (т) + H2 (г) = 2Hg (ж) + 2H+ (aq) + 2Cl– (aq)
от температуры J (°C): E = 0.2676 – 3.19×10–4(J – 25) (1)

Графики второго вида строятся аналогично. Если даны координаты точек (х, у), то сначала следует переписать их в виде таблицы, в порядке увеличения независимой переменной х. На основании этой таблицы выбрать интервалы изменения х и у и масштабы по тем же правилам, как объяснялось выше. Затем следует построить оси координат на миллиметровой бумаге и отметить точками (или другим геометрическим символом) на координатной плоскости каждую пару чисел (х, у). Точки должны быть такими, чтобы они были ясно видны на окончательном графике. Затем к этим точкам подбирают график. Если есть основания предполагать, что график должен быть линейным, то для построения графика используется линейка. Важно помнить, что заданные координаты всегда содержат некоторые погрешности. Когда мы строим график первого вида (для известной функции), у нас есть возможность вычислять координаты точек с произвольной точностью. Когда мы строим график по заданным координатам, погрешности фактически "заданы" и мы не можем их изменить. Если они сравнительно малы, то точки "ложатся на график хорошо", и построение графика не вызывает затруднений. Если погрешности велики, то график следует подбирать так, чтобы отклонение точек от него было минимальным. Например, пусть даны значения ЭДС при нескольких температурах для рассмотренной выше электрохимической реакции, которые записаны в виде таблицы:
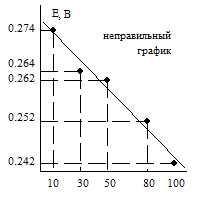
На рис. 3.4 (а) показан график, построенный по этим данным. Главный принцип этого построения состоит в следующем. Прямая линия должно быть проведена так, чтобы точки лежали либо непосредственно на ней, либо отклонялись от неё вверх и вниз (вдоль оси у) приблизительно в одинаковой степени, так чтобы все точки были удовлетворены по возможности одинаково. На рис. 3.4 (б, в г) показаны некоторые примеры неправильного построения графиков по тем же точкам. График по заданным точкам обычно строится не просто с целью иллюстрации, а для определения неизвестных коэффициентов функциональной зависимости по найденному геометрическому месту точек. Эта задача обсуждается в следующем приложении.
Приложение 4. Определение коэффициентов Функциональной зависимости
Многие задачи физической химии формулируются приблизительно так: Даны пары чисел (xi, yi), обычно в виде таблицы
Требуется определить коэффициенты уравнения y = a + bx, которое, как предполагается, лежит в основе по парного соответствия чисел xi и yi. Если бы число пар чисел (xi, yi) было равно двум, то коэффициенты находились бы решением системы уравнений y 1 = a + bx 1 y 2 = a + bx 2
Как известно, решением такой системы относительно a и b является:
Однако в большинстве задач число данных пар (xi, yi) превышает 2. Если бы данные числа были точными, то можно было бы выбрать любые две пары (xi, yi), составить из них систему уравнений и решить её относительно a и b. Такое решение было бы общим и единственным для всей таблицы. В реальных задачах, однако, числа (xi, yi) содержат погрешности измерений или округлений. С точки зрения чистой математики, в этом случае система уравнений не совместима и не имеет единственного решения. В прикладных науках проблема ставится несколько иначе: требуется найти такие коэффициенты a и b, которые удовлетворяют данным парам чисел (xi, yi), в некотором смысле, наилучшим образом. Для нахождения такого решения есть несколько методов. Ниже рассматриваются два из них, наиболее распространённые в исследовательской и инженерной практике.
Графический метод заключается в том, что на координатную плоскость наносят точки (xi, yi) и подбирают к ним график (прямую линию) так, чтобы отклонение точек от него было по возможности минимальным. Выбирают затем любые две точки, принадлежащие графику, определяют их координаты (x 1, y 1) и (x 2, y 2) и вычисляют a и b по уравнениям (1). Полученный коэффициент b называют угловым коэффициентом или коэффициентом наклона, а а – начальной ординатой графика или свободным членом линейного уравнения. Иногда процедуру определения b называют нахождением тангенса угла наклона, однако это нельзя понимать буквально, как определение угла наклона транспортиром в градусах и вычисление тангенса, потому что реальный угол наклона графика на рисунке зависит от выбранных масштабов шкал осей координат. Чтобы лучше понять этот метод, выполните следующее упражнение. Упражнение. Посмотрите на рис. 4.1 и внимательно прочтите подпись к нему. 1) Убедитесь, что уравнения 1 правильные. Для этого вычислите для графика А по координатам точек 1 (9, 14) и 2 (0, 10) коэффициенты:
Так как прямая А представляет график уравнения у = 10 + 0.444 х, должно получиться b = 0.444 и а = 10.0.
2) С помощью сетки на рис. 4.1 определите координаты точек 3 и 4 графика В. Постарайтесь сделать это с точностью до десятой доли цены деления шкалы каждой оси. Вычислите:
Если координаты определены правильно, то должно получиться b = –0.32 и а = 8.0, соответственно уравнению у = 8 – 0.322 х графика В. 3) Выберите любые две точки (их можно обозначить 5 и 6), принадлежащие графику С, и определите их координаты. (Обратите внимание, что черные точки, по которым построен график С, не принадлежат ему). Вычислите:
Тем самым определены коэффициенты линейной функции, заданной графиком. (Правильный результат определения b = 0.32 и а = 9.0)
Более точные значения a и b можно получить вычислительным методом наименьших квадратов (общепринятое сокращение МНК). Согласно этому методу, a и b должны быть такими, чтобы сумма квадратов отклонений
была минимальной. Из этого условия следует:
где N – число пар (xi, yi). Имея таблицу данных (xi, yi), a и b можно найти по уравнениям (2) без помощи графика. Тем не менее, график в этом случае обычно строят, чтобы убедиться, что все точки достаточно хорошо "ложатся" на прямую линию. Эти два метода применимы непосредственно только к линейным зависимостям. К сожалению, большинство теоретических уравнений физической химии являются нелинейными и могут содержать, в зависимости от конкретной задачи, один или более неизвестных коэффициентов, которые требуется определить. Если теоретическое уравнение, лежащее в основе данных пар чисел (Xi, Yi), является нелинейным вида Y = ¦(Х, A, B), то описанные выше методы можно применить после преобразования этого уравнения в линейное уравнение с новыми переменными y = a + bx, в котором х и у – функции Х и Y и любых известных параметров, но не искомых А и В, а a и b – функции искомых А и В и любых известных параметров, но не переменных Х и Y. Эта процедура называется линеаризацией функции. Вычислив новые переменные (xi, yi), их обрабатывают графическим или вычислительным методом, как описано выше, и из полученных коэффициентов a и b находят искомые А и В. В качестве примера рассмотрим следующую задачу. Найти число обращения фермента k и константу Михаэлиса К М в уравнении Михаэлиса-Ментена:
по следующим данным о зависимости начальной скорости v некоторой ферментативной реакции от начальной концентрации субстрата [S] при концентрации энзима [E]o 1.00×10–5 ммоль/л.
Так как уравнение (3) является нелинейным (гиперболическая функция), его следует преобразовать в линейное с новыми переменными, и применить методы определения коэффициентов, описанные выше. Возможны, например, следующие способы линеаризации. 1) Возьмем обратную величину от обоих частей уравнения (3):
Это уравнение имеет вид у = а + bx с у = v –1, x = [S]–1, a = (k [E]o)–1, b = K M(k [E]o)–1 = K M a. 2) Умножим обе части уравнения (4-1) на [S].
Это уравнение имеет вид у = а + bx с у = [S]/ v, x = [S], b = (k [E]o)–1, а = K M(k [E]o)–1 = K M b. 3) Умножим обе части уравнения (3) на знаменатель правой части:
vK M + v [S] = k [E]o[S]
Поделив обе части на [S], получим: v = k [E]o – K M v [S]–1 (4-3)
В этом линейном уравнении у = v, х = v [S]–1, a = k [E]o, b = – K M. Можно использовать любое из этих преобразований, чтобы найти коэффициенты а и b графическим методом или методом МНК и затем вычислить из них искомые k и К М. Рассмотрим подробно способ (4-1) с у = v –1, x = [S]–1, a = (k [E]o)–1, b = K M a. Перепишем данные величины [S] и v ×103 в отдельной таблице (столбцы 1 и 2 в табл. 4.1) и вычислим в ней обратные величины [S]–1 и (v ×103)–1 (столбцы 3 и 4). Построим график зависимости (×103)–1 от [S]–1. Как видно (рис. 4.2), график получается действительно линейным. Выберем на нём две точки произвольно, но с тем ограничением, чтобы они лежали не слишком близко друг к другу. (Если выбрать близко лежащие точки, то точность определения коэффициентов а и b может быть низкой). Например, это могут быть точки 1 и 2 (рис. 4.3) с абсциссами
Подставим теперь ([S]1–1, v 1–1) и ([S]2–1, v 2–1) в уравнения (1). Для углового коэффициента получим:
Для свободного члена а: a =
Таблица 4.1

Так как a = (k [E]o)–1, то k = (a [E]o)–1 = (1.76×103×1.00×10–5)–1 = 57 с–1. Так как b = K M a, то K M = b / a = 500/1.76×103 = 0.28 ммоль/л. Таким образом, k = 57 с–1, K M = 2.8×10–4 моль/л.
для свободного члена:
Очевидно, эти результаты практически совпадают с теми, что были получены графическим методом, однако они, в принципе, более точные, так как построение графика "по точкам" даёт надёжные результаты только тогда, когда точки "хорошо ложатся" на прямую линию.
Приложение 5. Примеры решения задач
Пример 1 (тема: второй закон термодинамики) Вычислить энтропию обратимого процесса, в начальном состоянии которого 2 моля идеального газа находятся при 20 °С и давлении 1.00 атм, а в конечном состоянии то же количество газа находится при 50 °С и давлении 7.75 атм. Молярная изобарная теплоёмкость газа 5 R /2. Решение. По условию задачи, идеальный газ претерпевает изменение температуры и давления в обратимом процессе. Поэтому первой целью является нахождение зависимости энтропии от температуры и давления. По второму закону термодинамики, изменение энтропии в обратимом процессе составляет d S = d Q / T. По первому закону d Q = d U + p d V, если механическая работа против внешнего давления является единственным видом работы, совершаемой системой. Отсюда следует общее уравнение: T d S = d U + p d V (1) С другой стороны, в условии задачи дана изобарная теплоёмкость, которая связана с внутренней энергией U через энтальпию H:
CP = d H /d T; CP d T = d H = d(U + pV) = d U + p d V + V d p
Выразим отсюда d U: d U = CP d T – p d V – V d p и подставим в (1): T d S = CP d T – p d V – V d p + p d V = CP d T – V d p
Таким образом, получено уравнение, выражающее энтропию обратимого процесса как функцию T и p:
В первом слагаемом, коэффициент СР = 5 R /2 не зависит от температуры, поэтому его можно интегрировать в том виде, как он есть. Коэффициент второго слагаемого, – V / T, является функцией давления. Для одного моля идеального газа можно записать pV = RT, откуда следует V / T = R / p. Таким образом, получается зависимость энтропии от температуры и давления в явном виде, пригодном для решения задачи:
Изменение энтропии можно найти интегрированием этого выражения в пределах температуры и давления, указанных в задаче (от Т 1 = 273 + 20 = 293 K и р 1 = 1.00 атм, до T 2 = 273 + 50 = 323 К и р 2 = 7.75 атм). Из приложения 4 узнаем, что первообразная от функции 1/ х равна ln(x). Поэтому:
Подставив соответствующие значения температуры и давления, получим D S = с единицами измерения, отвечающими газовой постоянной R, Дж/(моль К), так как логарифмические члены являются безразмерными. Таким образом, изменение энтропии составляет –15.0 Дж/К на 1 моль газа. (Фактически, получилось изменение молярной энтропии). В условии задачи требуется найти изменение для 2 молей газа, поэтому в окончательном ответе получим D S = 2×(–15.0) = –30.0 Дж/К. Заметим, что для вычисления дроби р 2/ р 1 можно использовать любые единицы измерения давления, так как дробь безразмерна и все единицы измерения давления пропорциональны друг другу. Поэтому в этом случае нет необходимости переводить атмосферы в единицы СИ, паскали. Однако, для вычисления дроби Т 2/ Т 1 градусы Цельсия необходимо перевести в единицы СИ, потому что практическая шкала Цельсия и шкала термодинамической температуры сдвинуты относительно друг друга на 273.15 К. То есть, температуры в этих шкалах не пропорциональны. Фактически, температуру Цельсия и термодинамическую температуру следует рассматривать как разные физические величины, что подчеркивается их обозначениями, J и Т.
Ответ: D S = –30.0 Дж/К
Пример 2 (тема: химические равновесия) Газообразные вещества А, В и Z реагируют по уравнению 1/2А + В = 3Z при повышенной температуре. Когда в реактор вводят 1/2 моля А и 1 моль В и смесь нагревают до равновесия при 500 К, равновесное количество А оказывается равным 0.450 моль, а суммарное равновесное давление партнеров реакции 50.3 кПа. Вычислите константы равновесия КР и КС, а так же стандартную энергию Гиббса реакции при этой температуре. Решение. По определению, константами равновесия КР и КС реакции 1/2А + В = 3Z называются величины:
где р А, р В и р Z – равновесные парциальные давления А, В и Z, С А, С В и С Z – равновесные молярные концентрации А, В и Z. Сосредоточимся сначала на константе КР. По закону Дальтона общее давление газовой смеси равно сумме парциальных давлений компонент: р = р А + р В + р Z причем парциальное давление любого компонента может быть найдено из общего давления, если известна мольная доля компонента в смеси: р А = х А р, р В = х В р, р Z = х Z р (мольная доля х – отношение числа молей данного компонента к числу молей всех компонент). Если парциальные давления в формуле для КР выразить через общее давление, то получится
Таким образом, начинать решение следует с вычисления равновесных чисел молей компонент. Чтобы сделать пример решения более общим, запишем уравнение реакции в виде: а А + b B = z Z (3)
Для вычисления мольных долей компонент, необходимо найти равновесные числа молей n B и n Z (n A известно из условия). Чтобы найти их, воспользуемся свойством стехиометрического уравнения, по которому изменения чисел молей D ni реагирующих веществ не независимы, а связаны между собой через химическую переменную x:
где ni – конечные (равновесные) ячисла молей участников реакции, ni ,0 – их числа молей, n i – стехиометрические коэффициенты со знаком плюс у продуктов и со знаком минус у исходных веществ. Так как известны все начальные числа молей и известно равновесное число молей А, то можно вычислить x по данным для А:
С помощью (5) вычисляем затем: n В = n В,0 – b x = 1 – 1×0.100 = 0.900 моль, n Z = n Z,0 + z x = 0 + 3×0.100 = 0.300 моль. Общее число молей в смеси при равновесии составляет n = n A + n B + n Z = 0.450 + 0.900 + 0.300 =1.650 моль. Поэтому
x A = 0.450/1.650 = 0.273, x B = 0.900/1.650 = 0.545, x Z = 0.300/1.650 = 0.182.
Подставив эти значения в уравнение (2), получим
Для вычисления К С необходимо знать, как давление газа связано с его концентрацией. Так как в условии задачи об этом не сказано ничего, предположим, что компоненты смеси имеют свойства идеального газа. Для идеального газа pV = nRT, откуда следует n / V = p / RT и C = p / RT, так как n / V (число молей /объём) = С (молярная концентрация), то есть С А = p А/ RT, С В = p В/ RT, С Z = p Z/ RT. Подставляя эти выражения в определяющее уравнение для К C (уравнение 1), получим:
2.38×105×(8.315×500)–3/2 = 0.888 с единицами измерения:
(смотри приложение 1 для перевода единиц измерения). Таким образом, КР = 2.38×105 Па3/2, КС = 0.888 (моль/м3)3/2. Стандартную энергию Гиббса реакции необходимо вычислять по уравнению D G ° = – RT ln K°, где К° – термодинамическая константа равновесия (безразмерная величина), связанная с активностями компонент. Так как наша газовая смесь предполагается идеальной, коэффициенты активностей равны 1 и константа К° равна численному значению (то есть, значению без единиц измерения) константы КР или КС. Однако численные значения термодинамических функций зависят от стандартного состояния, от которого отсчитываются их изменение. Если возьмем численное значение КР = 2.38×105 в качестве К°, то получим величину D G ° = –51.5 кДж/моль, которая относится к стандартному состоянию газа с давлением 1 Па. Эта величина D G ° имеет смысл изменения энергии Гиббса в обратимом процессе, ведущем от начального состояния, в котором p A = 1 Па, p B = 1 Па, p Z = 0 Па, к конечному состоянию с p A = 0 Па, p B = 0 Па, p Z = 1 Па. Если возьмем численное значение КС = 0.888, то получим величину D G ° = 0.494 кДж/моль. Эта величина относится к обратимому процессу, ведущему от начального состояния с концентрациями C A = 1 моль/м3, C B = 1 моль/м3, C Z = 0 моль/м3, к конечному состоянию с концентрациями C A = 0 моль/м3, C B = 0 моль/м3, C Z = 1 моль/м3. Стандартные состояния являются предметом профессиональных конвенций (договорённостей между химиками). Общепринятым (то есть, конвенционным) стандартным состоянием газообразных веществ является такое, в котором газ имеет идеальные свойства и давление р ° = 1 атм* (р ° – парциальное давление в смеси или общее давление в однокомпонентной системе). Поэтому, для правильного решения, КР или КС следует перевести в атмосферы, и численное значение использовать в качестве К°. Из приложения 1 можно узнать, что 1 атм = 1.01325×105 Па, откуда следует 1 Па = (1.01325×105)–1 атм = 9.869×10–6 атм. Таким образом:
КР = 2.38×105 Па3/2 = 2.38×105×(9.869×10–6 атм)3/2 = 2.38×105×(9.869×10–6) 3/2 (атм)3/2
= 2.38×105×3.100 ×10–8 атм3/2 = 7.379×10–3 атм3/2
К° = 7.379×10–3
D G ° = – RT ln K° = – 8.315×500×ln(7.379×10–3) = 2.04×104
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 610; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.018 с.) |



 , am =
, am = 

 .
. Предположим, требуется построить график зависимости э.д.с. (E, В) электрохимической реакции в водной среде:
Предположим, требуется построить график зависимости э.д.с. (E, В) электрохимической реакции в водной среде: ;
;  или a = y 1 – bx 1 или a = y 2 – bx 2 (1)
или a = y 1 – bx 1 или a = y 2 – bx 2 (1)


 ; a = y 1 – bx 1 = 14 – b× 9 =
; a = y 1 – bx 1 = 14 – b× 9 =
 и a = y 4 – bx 4 или
и a = y 4 – bx 4 или  и a = y 3 – bx 3
и a = y 3 – bx 3 и a = y 6 – bx 6
и a = y 6 – bx 6
 ,
,  (2)
(2) (3)
(3) (4-1)
(4-1) (4-2)
(4-2) = 0.25 л/ммоль и
= 0.25 л/ммоль и  = 3.8 л/ммоль. Определим их ординаты из графика:
= 3.8 л/ммоль. Определим их ординаты из графика:  = 1.88 л·с/ммоль и
= 1.88 л·с/ммоль и  = 3.64 л·с/ммоль. Однако для вычисления а и b нужны координаты ([S]1–1, v 1–1) и ([S]2–1, v 2–1), а не их десятичные производные. Поэтому преобразуем полученные ординаты:
= 3.64 л·с/ммоль. Однако для вычисления а и b нужны координаты ([S]1–1, v 1–1) и ([S]2–1, v 2–1), а не их десятичные производные. Поэтому преобразуем полученные ординаты: = 1.88 л·с/ммоль;
= 1.88 л·с/ммоль;  = 1.88×103 л·с/ммоль;
= 1.88×103 л·с/ммоль; = 3.64 л·с/ммоль;
= 3.64 л·с/ммоль;  = 3.64×103 л·с/ммоль;
= 3.64×103 л·с/ммоль;
 = 500 с.
= 500 с. = 1.88×103 – 500×0.25 = 1.76×103 л·с/ммоль.
= 1.88×103 – 500×0.25 = 1.76×103 л·с/ммоль.
 = 493 с
= 493 с = 1.76×103 с·л/ммоль
= 1.76×103 с·л/ммоль


 =
=  =
= 
 = –15.0
= –15.0 и
и  (1)
(1) (2)
(2) (где а, b, z – стехиометрические коэффициенты) и введём обозначения: n – общее число молей при равновесии, n A0, n B0, n Z0 – начальные числа молей компонент, которые были введены в реактор, n A, n B, n Z – равновесные числа молей компонент. Условие задачи в этих обозначениях выглядит, как показано в рамке справа.
(где а, b, z – стехиометрические коэффициенты) и введём обозначения: n – общее число молей при равновесии, n A0, n B0, n Z0 – начальные числа молей компонент, которые были введены в реактор, n A, n B, n Z – равновесные числа молей компонент. Условие задачи в этих обозначениях выглядит, как показано в рамке справа. , (4)
, (4) , (5)
, (5)
 2.38×105 Па3/2
2.38×105 Па3/2 =
=  =
= =
=  =
=  =
= 



