
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічні властивості галогенпохіднихСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
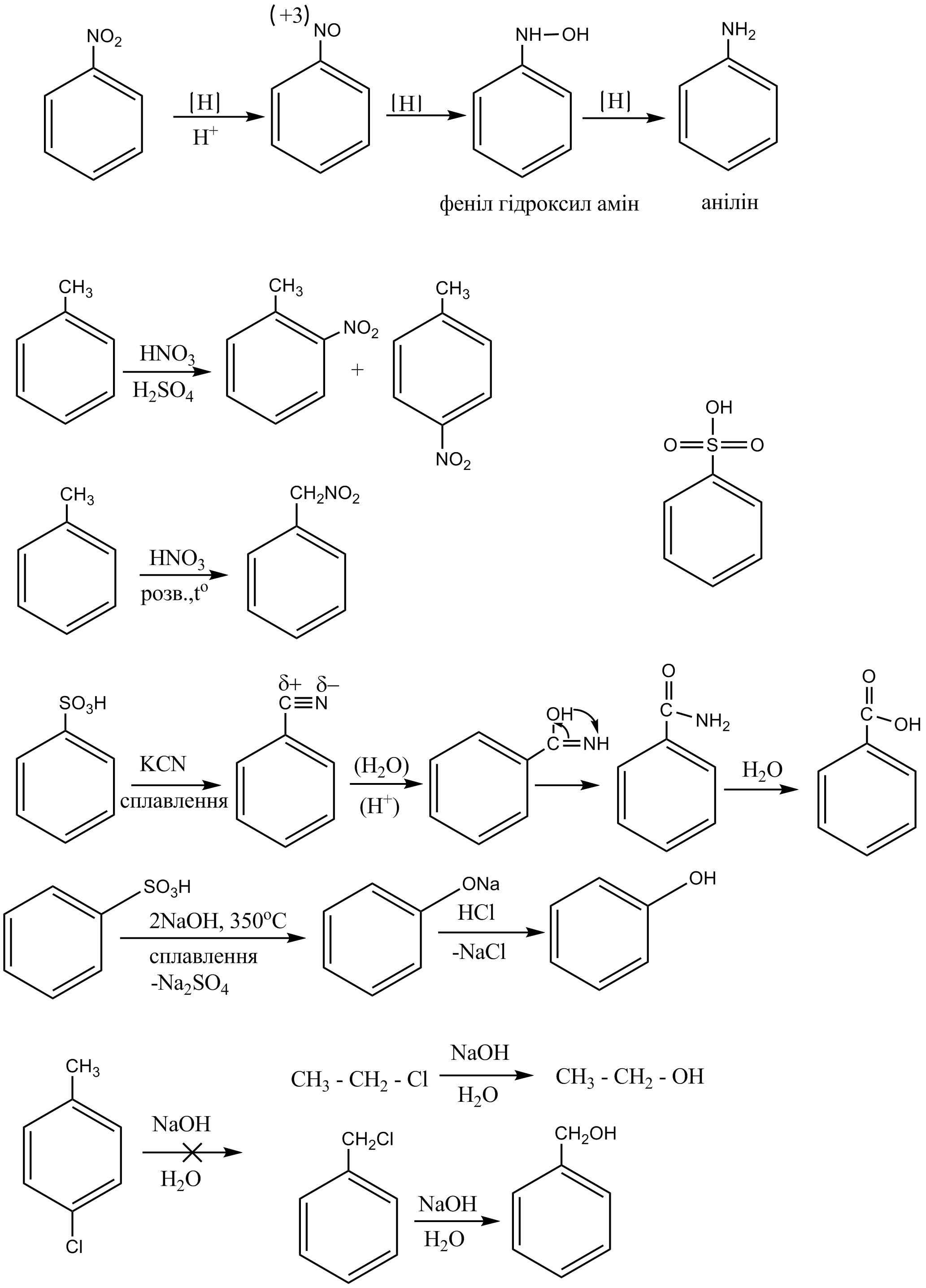
Електрофільне заміщення відбувається в n-положенні, порівняно з бензолом відбувається гірше. Перевагу цьому
Нуклеофільне заміщення(SN) Галогенпохідні утворення реактиви Гріньяра
Ароматичні сульфокислоти
ХІМІЧНІ ВЛАСТИВОСТІ 1)Реакції за кислотною групою
2) Заміщення сульфогрупи а)електрофільне єдиною зворотньою реакцією електрофільне заміщення є десульфування:
б)нуклеофільне заміщення
Реакції електрофільного заміщення в ядрі відбувається дуже важко. Алкілування та ацелювання зовсім не відбувається. Хлорування та нітрування – при to. НІТРОСПОЛУКИ Якщо в сполуці присутня NO2 група в боковому ланцюзі – поводить себе як нітроалкан.
ХІМІЧНІ ВЛАСТИВОСТІ НІТРОСПОЛУК 1)Відновлення в кислому середовищі:
в лужних умовах:
2)Електрофільне заміщення NO2 дезактивує ароматичне кільце в реакціях електрофільного заміщення. Ацелювання та алкілування не відбувається, бо NO2 – замісник ІІ-го роду. 3)Нуклеофільне заміщення
NO2 активує ароматичну систему до реакції нуклеофільного заміщення.
Якщо є 2 NO2 – групи, а потрібно відновити лише 1, то застосовуємо (NH4)2S ФЕНОЛИ
Добування 1. З кам’яновугільної смоли. 2. З хлорбензолу. 3.Кумольний метод Механізм:
4.З діазосполук: ХІМІЧНІ ВЛАСТИВОСТІ ФЕНОЛІВ Фенолят аніон Феноли значно кисліші, ніж спирти Кфенолу=10-10; Кводи = 1,8
З NaOH
Як з FeCl3 фенолят натрію Двохатомні феноли:
n-диізопропіл бензен
Трьохатомні феноли:
Властивості: + хінони
Ароматичні аміни
Методи добування 1. Відновлення з нітробензолу
Перегрупування Гофмана анілін n-метиланілін Якщо треба добути N,N-диметиланілін, ще раз додаємо CH3OH! N-феніламід оцтової к-ти N-метил-N-феніламід N-метиланілін ацетат
ХІМІЧНІ ВЛАСТИВОСТІ Аміни як основи
Косн. 1,8•10-5 11•10-10 4•10-10 1,5•10-4 N,N-диметиланілін анілін етиламін Акцепт. заміс. NO2, бо ще й NO2 забирає густину.
Трифеніламін не проявляє основних властивостей.
Реакція алкілування Якщо треба ввести замісник в кільце, то треба захистити аміногрупу! Використ. ангідрид, безпосередньо оцтову кислоту використ. при tº; далі можна проводити реакції заміщення в бензольному кільці:
Взаємодія аніліну з карбонільними сполуками відбувається з утворенням основ Шиффа. Ізонітрильна проба
Взаємодія аніліну з нітратною кислотою:
N-нітрозо-N-метиланілін
Окиснення
аніліновий чорний
Реакції заміщення
чорна смола
анілін анілін Такі ж реакції, як і для аліфатичних амінів. спирт алкен Азо-, діазосполуки
Солі діафонію
Механізм:
Солі діазонію існують у кислому середовищі (0 – 5 ºС). Якщо аміногрупа приєднана до аліфатичного фрагменту, а не безпосередньо до бензольного кільця, діазо-сполуки поводять себе так само, як і аліфатичні. Для солей діазонію характерні реакції з виділенням азоту і без. 1) З виділенням азоту: a) Без каталізатора
Якщо в системі присутня сіль KI (KBr): Реакція дезамінування: Дозволяє замістити: - NH2; - N+ b) з каталізатором Реакція Зангмейера аналог з KBr, KNO2; діазо на NO2
Механізм: 2) Реакції без виділення азоту Реакція відновлення промисловий метод добування Реакція окиснення Реакції азосполучення Сіль діафонію є дуже слабким електрофілом. Відповідно для проходження реакції треба застосувати ароматичні сполуки, що є сильними орієнтантами 1 роду.
Реакцію утворення азосполук за участю діазонієвих солей (діазокомпонент) та активованих електронодонорними замісниками аренів (азокомпонент). Т-комплекс
Діазосполуки не взаємодіють з бензолом, толуеном, нітробензолом.
Ароматичні альдегіди і кетони бензальдегід саліциловий ацетофенон о-гідроксибенз альдегід
Методи добування
Реакція Реймена-Тімена Відновлення хлорангідридів по Роземунду Отримання кетонів фенілметілкарбінол
Механізм:
Піроліз дикарбонових кислот
Хімічні властивості
сіль спирт Р-ція Каніцарро Альдольна конденсація відбувається, якщо є альфа-гідрог. Атоми, але не відб. для:
Реакція Перкіна Бензоїнова коденсація
Механізм:
З гідросульфатом натрію бензофенон не взаємодіє! При дії відновн. (Zn + HCl) бензофенон відновл. до етилбензену. При окисненні: Гр. – COH до 2 р. замісн. Хінони
Добування:
хінондіімін Ароматичні карбонові кислоти
Методи добування: окиснення альдегідів, алкіл бензолів, бензофенолу, ароматичних спиртів – утвор. бензойна к-та. Гідроліз тригалогенопохідних: Хімічні властивості Утвор. солей хлорангідридів, естерів аналогічно реакціям аліфатичних кислот. Заміщення в бенз. ядрі. Замісник 2 роду. Орієнтує в м-n. Відбувається сульфування, нітрування, галогенування.
Ароматичні системи з кількома бензольними ядрами.
Бензольне кільце – замісник 1 роду. Добування: гідробензол
Атропоізомерія обертання навколо σ – зв’язку, що з’єднує 2 бензольні кільця. дифенова кислота
Енантіомери виникають внаслідок неможливості обертання навколо σ – зв’язку. Дифенілметан (так само, як CH3Cl)
Якщо: бензгідрол бензгідрилбромід
схожі з циклопентадієном)
Трифенілметан
Трифенілметильний катіон та аніон існують за рахунок мезомерного ефекту. Структура трифенілметанолу не плоска і всі кільця повернуті на 80-90° до площини.
Утворення барвника малахітовий зелений:
немає супряження, тому безбарвне Фенолфталеїн набуває малинового забарвлення при pH= 8 – 10. Нафталін о- пері- амфі- Це ароматична сполука, оскільки є спряженою системою з 10 електронами. Перерозподіл електронної густини нафталіну нерівномірний; електронна густина зосереджена в α – положенні, тому нафталін активний в реакціях електрофільного заміщення по α – положенню. фталева кислота Нафталін є більш активним в реакціях електрофільного заміщення, ніж бензол. α β
кінетично по α – положенню р-ція йде легше термодинамічно більш стійкі; енергетично вигідніші.
Термодинамічно-кінетичний контроль
α вих. β
Отримання α-нафтилоцтової кислоти Реакція тільки для β – нафтиламіну: Правила заміщення в нафталіні · якщо замісник 1 роду знаходиться в α – положенні, то наступний замісник буде заміщув. в 4 положенні, далі в 2.
n-нітро- α-нафтал
· якщо замісник 1 роду знаходиться в β – положенні, він орієнтує заміщення в 1 положенні. · якщо замісник 2 роду знаходиться в α – положенні, він орієнтує заміщення в 5 та 8 положеннях (переважно у 8).
· якщо замісник 2 роду знаходиться в β – положенні, він орієнтує заміщення в 5 положенні. Відновлення
тетралін декалін
Антрацен Добування:
Хімічні властивості Р-ція Дільса – Альдера В антрацені середнє кільце може вступати в реакції по типу 1,4 аналог. дієнам.
Алізарин використовується для якісного визначення йонів в середовищі, з Fe+3 – фіолетове, Al+3 – червоне, Cr+3 – вишневе.
Фенантрен
Метод Шора
Фенантрен легко вступає в реакції електрофільного заміщення (9, 10), а також окислення і відновлення.
Гетероциклічні сполуки є ароматичними сполуками (4n+2), найбільшу ароматичність проявляє тіофен, оскільки сірка є найменш ЕНатомом і слабше тримає електрони. пірол фуран тіофен Пірол і фуран проявляють ацидофобні властивості, тобто полімеризуються при дії будь-яких кислот (в тому числі і к-т Льюїса).
Методи добування Перетворення за Юрієвим (Al2O3; 450 ºC для всіх)
фурфурол
Хімічні властивості Фуран, пірол і тіофен вступають в реакції електрофільного заміщення по α – атому водню (позитивний заряд частин).
Хлорування
Ацилювання
Азосполучення
1) 2)
Чому заміщення йде в α – положенні? Якщо + може бути стабілізований більшою кількістю резонансних форм, тому σ – комплекс стабільніший. В α – положенні більше скупчення електронної густини. Відновлення
Окиснення
Р-ція Дільса – Альдера Фурфурол Характерні властивості для бензальдегіду. фуроїн фурфуриновий спирт утвор. спирт, сіль, якщо немає α – водню фурацилін Пірол схожий за своїми властивостями на фенол. замінник плазми крові – пірамідон
Піридин Добуваєься з кам’яновугільної смоли (C5H5N) як основа
Пірідин є ароматичною сполукою, вступає в реакції заміщення; в реакціях електрофільного заміщення є малоактивним і нагадує нітробензол. Оскільки атом N стягує на себе електронну густину – є більш ЕН елементом, ніж карбон, тому електрофільне заміщення відбувається по β – положенню.
Механізм Піридин здатен вступати в реакції нуклеофільного заміщення, які відбуваються по α – положенню. Реакція Чичебабіна Якщо гідроксильна група розташована в β – положенні, ця сполука проявляє властивості характерні для фенолів; аміногрупа в β – положенні – властивості, притаманні для ароматичних амінів (напр., вступає в реакцію діазотування). Якщо ОН група знаходиться в α – положенні:
Відновлення піридину
Індол Ацидофобна речовина (при дії кислоти – полімеризується по 3 положенню). Є активним в реакціях електрофільного заміщення. Використовується для введення SO3 – групи для фурану і піролу, бо вони – ацдофільні. 6,6 - дибромоіндіго
індіго-кармін
триптофан
Добування
Хінолін Реакції електрофільного заміщення йдуть по бензольному кільцю, нуклеофільного – по піридиновому.
Хлорамін Б Дисульфан
Стрептоцид білий Норсульфазол Сульфідин
|
||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 560; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.71.207 (0.012 с.) |

 10-16; Кетилового спирту = 10-18
10-16; Кетилового спирту = 10-18




