
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теорія будови органічних сполук бутлероваСодержание книги
Поиск на нашем сайте
ПРЕДМЕТ ОРГАНІЧНОЇ ХІМІЇ. ТЕОРІЯ ХІМ. БУДОВИ БУТЛЕРОВА. ПРИРОДА ЗВ’ЯЗКІВ В ОРГАНІЧНИХ МОЛЕКУЛАХ. ОРГАНІЧНІ РЕАКЦІЇ ЗА ХАРАКТЕРОМ ХІМІЧНОГО ПЕРЕТВОРЕННЯ, А ТАКОЖ В ЗАЛЕЖНОСТІ ВІД СПОСОБУ РОЗРИВУ ЗВ’ЯЗКУ.ПОНЯТТЯ ПРО ПРОМІЖНІ ЧАСТИНКИ: РАДИКАЛИ, АНІОНИ, КАРБАНІОНИ. Предметом органічної хімії є встановлення порядку сполучення атомів у молекулі, їх взаємного впливу, просторового розміщення, а також вивчення їх реакційної здатності. Органічна хімія - хімія вуглеводнів та їх похідних. Органічні молекули складаються з С та Н, а також О2, азот, галогени, сірка. ТЕОРІЯ БУДОВИ ОРГАНІЧНИХ СПОЛУК БУТЛЕРОВА 1) Природа органічної речовини: визначається якісним, кількісним складом і хімічною будовою молекул. 2) Хімічна будова – певний порядок у сполученні атомів у молекулі та їх вазємний вплив. 3) Хімічна будова визначає фіз.. та хім.. властивості речовини, відповідно можна встановити хімічну будову, знаючи хімічні і фізичні властивості сполук 4) Речовини, що мають однаковий якісний і кількісний склад, але різну хімічну будову, називаються ізомерами. С 1s2 2s22p2 2s *C Ковалентний зв'язок – зв'язок, утворений між атомами внаслідок узагальнення їх зовнішніх електронних підрівнів. Σ-зв'язок утворений перекриванням s, p орбіта лями вздовж осі, що з’єднує центри атомів. C-H π-звязки утворюються бічним перекриванням p-орбіталей вздовж площини, що проходить крізь ядра двох атомів. N2 зовнішній ел. рівень
ВУГЛЕВОДНІ Тема. Алкани, будова алканів, тетраедрична модель молекули метану, характеристика σ-звязків, С-С, С-Н, поняття про вільне обертання навколо зв’язків С-С, конформації (оборотні ізомери), методи добування алканів.
Класичні вуглеводні (алкани) – вуглеводні з відкритим ланцюгом, атоми С зв’язані між собою одинарними зв’язками, всі атоми у стані sp3 гібридизації. С-С 0,154 нм 230-360 кДж/моль С-Н 0,109 нм 410-430 кДж/моль С-Н більш міцний, але швидше розривається, об знаходиться на поверхні молекулию Конформаційна ізомерія зумовлює обертання атомів або груп атомів навколо зв’язку С-С. Етан Затінена конформація Загальмованя конформація
Алкан лінійної будови
Промислові методи добування 1. Оксосинтез (метод Фішера-Тропша) СО і Н2 – синтез-газ у різних співвідношеннях Утв. переважно суміш вуглеводнів, які складаються в основному з алканів лінійної будови (n=2-18), називається «синтином». Синтез-газ отримують газифікацією кам’яного вугілля:
2. Конверсією метану: 3. Метод гідрування вугілля (Берцеліус): 4. Гідрування ненасичених алкенів:
Бо водень на повітрі стає більш активним
Лабораторні методи 1. Р-я Вюрца (одержання з галоген алкінів)
Механізм для цього перетворення: застосовується лише для симетричних похідних
утворюється суміш похідних, тому не використовується
2. Реакція Корі-Хауса (вз-я з літійдіалкіл-купратами галогенпохідних)
Для отримання
При застосуванні первинних галогенпохідних вихід реакціїї становить до 100%; вторинних та третинних – знижується до 30-50% 3. Метод Дюма (сплавлення натрєвих солей карбонових вислот з лугами):
сіль 3 метилпентанової килоти 4. Метод Кольбе (електроліз солей карбонових кислот)
Радикал
натрієва сіль 2 метилпропанової к-ти
Відновлення галогеналканів 1) Каталітично збудженим воднем 2) Відновлення атомарним воднем (з`являється в момент утворення неспр, при взаємодії Ме з HCl). 3) Відновлення кисневмісних сполук йодоводнем (спиртів, кетонів) Ацетон пропан Для добування використовується метод Дюма ХІМІЧНІ ВЛАСТИВОСТІ АЛКАНІВ Алкани – повн. насичені сполуки, тому не вступають у реакції приєднання. Вони досить інертні і не взаємодіють за н.у. з кислотами, лугами, окисниками, активними Ме, тому їх називають «парафінами». Зв`язки С-Н і особл. С-С малополярні; важко поляризуються. Енергія σ-звязку С-С – 330-360кДж/моль С-Н – 402-455 кДж/моль Однак частіше розщеплюється стійкий С-Н-звязки, оскільки вони доступніші для атаки реагентів. Відщеплення е стає легшим для сполук з більшою молекулярною масою; зростає загальна кількість σ-звязків, зростають їх донорні властивості У вільнорадикальних процесах реакції відбуваються переходи біля третинного атома вуглецю, далі біля вторинного і в останню чергу біля первинного. Для алканів характерні реакції: 1) Заміщення водню, в основному за радикальним механізмом. 2) Розщеплення молекул за звязками С-С або С-Н. Реакції галогенування (заміщення Н на атом галогену): F > Cl > Br > I ↓ швидкість реакції, усі реакції з F відбуваються з вибухом
Реакції хлорування менш екзотермічні, проходять за умови УФ-опромінювання Хімічні властивості алкенів Реакції приєднання; окиснення; полімеризації; заміщення біля α-атома карбону до подвійного зв’язку. Реакції приєднання 1. Гідрування Правило Лебедєва: алкени тим легше гідруються, тим менше замісників знаходяться біля С.
2. Галогенування (приєднання НаІ)
Радикальний механізм (поч з hv)
Електрофільний механізм 3. Гідрогалогенування (приєднання ННаІ) HI > HBr > HCl > HF (знижується швидкість приєднання) Механізм
За правилом Марковнікова Н приєднується до найбільшого гідрогенізованого атома С з двох атомів С подвійного зв’язку. · Приєднання гіпогалогенідів
· Гідратація алкенів (приєднання Н2О) по правилу Марковникова Реакції гідратації і дегідратації проходить через однакові ітермедіати – принцип мікроскопічної зворотності. Алкени добре поглинаються сірчатою кислотою, для деяких алкенів існує своя концентрація кислоти, наприклад, етилен поглинає 90-94% кислоти, пропілен 70-78%, ізобутилен 30-35% Н2SO4 . Цей метод застосовують у промисловості для розділу віглеводнів. Найпростіший шлях добування алкенів - виділ з продуктів крекінгу нафти та природного газу або безпосередньо з деяких сортів нафти. За номенклатурою ІИ РАС назви алкенів утворилися від назв відповідних алканів заміною закінчується –ан на –ен. Гологеновий ланцюг обов’язково повинен включати подвійний зв’язок і його нумерація починається з кінця, до якого ближче розташован =. Положення = в ланцюгу молекул позначається цифрою – положення двовуглецевого атома, біля якого він знаходиться. Назви залишків алкенів (алкенільних груп) утворюються приєднанням до назви алкену закінчується –ил (іл). СН2=СН – вініл (етеніл) СН3 – СН=СН – 1пропеніл СН3 – СН=СН – СН2 – кротил СН2=СН – СН2 – аміл (2-пропеніл) СН2=С(СН3) – ізопропеніл (1-метилетеніл) АЛКІНИ Добування, будова, хімічні властивості, реакції нуклеофільного та електрофільного приєднання, гідратація (реакція Кучерова), кислотні властивості алкінів з кінцевим потрійним зв`язком, утворення ацетиламідів,конденсація з карбонільними сполуками (реакція Реппе, реакція Фаворського)
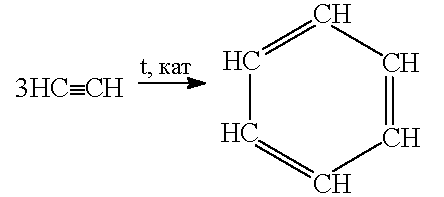
Промислові методи добування Карбідний метод
Піроліз метану Лабораторні методи добування 1) Дегідрогалогенування (-Hhal) віцинальне галогенпохідне гемінальне 2) Алкілування ацетилену
Хімічні властивості Оскільки атом С біля потрійного зв`язку більш ЕН, відповідний е- π-зв`язку сильніше притягується до ядра, менш рухливі. Це пояснюється тим, що алкіни менш активні в реакціях електрофільного приєднання, але можуть вступати в реакції нуклеофільного приєднання на відміну від алкенів. 1. Гідрування
2. Приєднання галогенів
3. Приєднання кислот
полівініловий спирт
Реакця Кучерова Таутомери - ізомери, які знаходяться у рухомій рівновазі і відрізняються положенням атомів Н, а також природою і положення подвійного зв`язку.
Альдегіди утворюються тільки у випадку ацетилену, у всіх інших випадках – кетони: Реакція нуклеофільного приєднання до алкінів (приєднання спиртів)
механізм:
Кислотні властивості
Ацетиленід срібла при повному висиханні може вибухати
Реакція Реппе (добування дивінілу – 1,3 бутадієну)
Реакція Фаворського (добування ізопрену з ацетилену)
Полімеризація. Димеризація Коли в молекулі зустрічається одночасно подв. і потрійний зв`язки, домінуючий – подвійний Тримеризація
Окислення алкінів
АЛКАДІЄНИ CnH2n-2 1. Кумульовані CH2=C=CH2 (sp-гібридизація) 2. З ізольованими подвійними зв’язками CH2=CH-(CH2)n-CH=CH2 3. Спряжені CH2=CH-CH=CH2 Нестійкий енол
ален з ізольованим подвійним звязком такі ж властивості, як і в алкенів спряжені дієни Особливості будови спряжених дієнів. В них відбувається перерозподіл електронної густини за рахунок мезомерного ефекту. В спряжених дієнах утворюється π-електронна хмара, що охоплює всі атоми карбону, що належить до спряженої системи.
Енергія спряження = 14,6 кДж/моль. π-електронна густина максимально зосереджується між 1,2,3 і 4 атомами, але також є і між 2 і 3. Промислові методи добування Дегідрування алканів Метод Лебедєва
Реакція Прінса
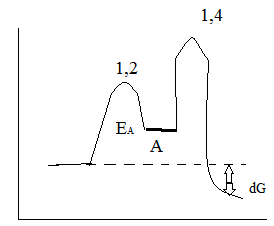
Хімічні властивості дієнів Реакція приєднання гідрування Кінетичний контроль- коли напрямок і швидкість реакції залежить тільки від значення ЕА енергії активації (утворюється продукт, що швидше) Термодинамічний- це контроль, коли напрямок і швидкість реакції залежить від значення вільної ентальпії реакції ∆G.
Резонансні форми
При 80°С продукту: 80°С 20°С 1,2 буде 80% 20% 1,4 - 20% 80% АЕ Механізм електрофільного приєднання Br: Катіони амільно типу АR Радикальний механізм
(йодування і хлорування так само) Приєднання Ннal
Дієновий синтез Дільса-Альдера Вступає лише ізопрен Дієн дієнофіл Акрилонітрил акролеїн малеїновий ангідрид Полімеризація При полімеризації ізопрену утворюються синтетичні каучуки. Поляризація катіонна
Окислення озоноліз Стереохімія - поняття про асиметричний атом С, проекційні формули Фимера, оптичні антиподи, рацемати, їх властивості, поняття про відносну та абсолютну конфігурацію, діастереомери, мезоформи. Оптична активність органічних сполук- здатність сполук обертати площину плоско-поляризованого світла. Використовуються поляриметри
ПРИЗМА кювета(повертається) призма (поляризується) +α-правообрт.; - α лівооберт оптичні антиподи Для порівняння оптично-активних різних енантіомерів використовується поняття «питоме обертання», що характеризує оптичну активність енантіомера при його концентрації 1г/мл і довжині кювети (чи трубки) 1 метр.
експериментально визначений кут обертання площини поляризації Оптичні ізомери мають однакову хімічну будову, відрізняється розташуванням атомів у просторі. Оптичну активність проявляють сполуки, молекули яких побудовані несиметрично, тобто відсутні елементи симетрії (вісь, площина). Елантіомерія - явище існування 20х дзеркальних об’єктів, які не суміщені у просторі. Хіральність- здатність будь-якого предмету мати своє дзеркальне відображення, не тотожне оригіналу. Абсолютна конфігурація
Реакція Реппе Хімічні властивості Гліцерин є більш сильною кислотою, ніж одно- і двоатомні спирти. Буде взаємодіяти з NaOH; сильніший, ніж кислота. ЯК Дегідратація Акралеїн-лакріматор, подразник слизової оболонки. Окиснення Селективно щось отримати важко.
ЕТЕРИ. ПРОСТІ ЕФІРИ. R-O-R Методи добування 1. СН3СН2О Na+Br CH2CH3→CH3CH2OCH2CH3+NaBr Взаємодія алкогометів з галогенопохідними. 2. Міжмолекулярна дегідратація спиртів. Хімічні властивості За кімнатною температурою прості ефіри не взаємодіють з Na, не взаємодіють з Н2О – за умовою як кислоти, так і лужного каталізу. · Прості ефіри розкладаються сильними кислотами · Утворюють оксонієві сполуки. При тривалому зберіганні прості ефіри здатні утворювати пероксиди.
Можуть вилучати йони з навколишнього середовища.
Оксид етилену
Альдегіди і кетони (містять карбонільну групу)
Кетон
Альдегід Пропаналь
Методи одержання 1. За допомогою окиснення
- Окиснення алканів
- Окиснення алкенів 4-мети 2-пентен Ізобутиратний альдегід 2. Основний метод добування формальдегіду в промисловості – каталітичне окиснення метанолу: 3. Оксосинтез (гідроформілювання алкенів):
Оцтовий альдегід утворюється тільки з ацетилену, в інших випадках утворюються кетони 4. Гідроліз гемінальних полігалогенпохідних 5. Дегідрування, окиснення спиртів, озоноліз алкенів і дієнів
Оксосинтез В промисловості цим методом добувають бутаналь і вторбутаналь.
1. Гідроліз солей карбонових кислот
2. Відновлення по Розенмунду
SN1
Тому в SN2 буде рацемат: SN2 KCN, AgNO2 – по Sn2 З Na взаємодіють всі спирти з виділенням Н2 SOCl2 заміщає OH на Cl
МЕХАНІЗМ
Реакція Віттіга дозволяє з карбонільних сполук утворювати алкени:
Ненасичені карбонільні сполуки:
Акролеїн метил вініл кетон
ДОБУВАННЯ: 1. Дегідратація гліцерину 2. Альдольна конденсація: 3. Окиснення пропілену:
Проти правила Марковнікова МЕХАНІЗМ
КЕТОНИ (із ацетона при високих температурах йдуть радикальні реакції) Диальдегіди, дикетони
Естерова конденсація Кляйзена:
Кето-енольна таутомерія для ацетил ацетону: Фактори, які стабілізують фенольну форму: - Водневий зв'язок внутрішньо молекулярний - Подвійний зв'язок розташований через один, тому утворюється спряжена система - Шестичленний цикл, що найбільш стабільний Як на фенольну форму є рекція з FeCl3; фіолетовий за рахунок утворення комплексної сполуки.
Карбонові кислоти
Методи добування: 1. Окиснення алкенів (в промисловості) 2. Оксосинтез 3. Окисненя спиртів, альдегідів і кетонів
Лабораторні методи: 1) Нітрильний 2) Застосування реактивів Гріньяра
Синтези на основі ацетооцтового естеру:
кислі протони біля групи СH2
Кислотне розщеплення:
Синтез на основі диетил:
Конденсація Кляйзена:
Між карбоксильними групами кислот існують водневі зв’язки навіть у газовій фазі кислоти у вигдялі димерів.
МЕХАНІЗМ
Добування 1) Окиснення бензолу
Використовують у дієновому синтезі
Якщо в молекулі декілька асиметричних атомів С, то для карбонових і для амінокислот конфігурація визначається за положенням замісників біля верхнього асиметричного атома. Для вуглеводів – біля нижнього 2n кількість асиметричних атомів С.
Оксокислоти (де є карбонільна група) Механізм конденсації Кляйзена:
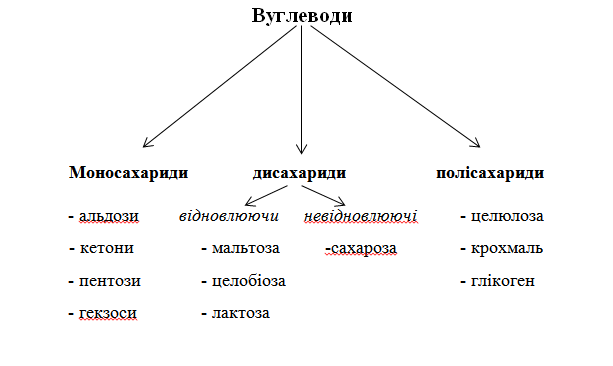
ВУГЛЕВОДИ Вуглеводи Cn(H2O)m – природні сполуки, які є полігідроксикетонами та полігідроксиальдегідами, а також продукти їх конденсації.
Вуглеводні здатні утворювати циклічні форми.
Утворення напівацеталей:
Ізомери, які відрізняються розташуванням глікозидного гідроксилу називаютьяс аномерами. В речовині відкритої форми 0, 002%, β-форми – 64%, α-форми – 36%. Мутаротація – зміна кута обертання площини плоскополяризованого світла при проходженні через розчин аномера. Цей кут α=53◦.
Фуранозний:
Добувають гідролізом крохмалю: Окиснення:
Зменшення ланцюга з гексоз до пентоз:
Епімери – ізомери, які відрізняються конфігурацією першого асиметричного атома С. Епімеризація відбувається в лужних розчинах:
Взаємодія з феніл-гідразином: Озазон за звичайних умов існує в кристалічному вигляді і застосовується для ідентифікації вихідних речовин. Алкілування глюкози:
При гідролізі в м’яких умовах спочатку гідролізується група:
Вітамін С Бродіння глюкози Анаеробне бродіння - Молочно-кисле - Спиртове - Гліцеринове - Бутиратно-кисле - Пропіонове - Ацетоново-бутанове Реакція утворення ацеталів:
Дисахариди - Відновлюючи (ті, що вступаютьвреакції окиснення) - Невідновлюючі
Невідновлюючі Сахароза утворена залишками α-D-глюкози і β-D-фруктози. Не дає реакцію срібного дзеркала.
Відновлюючі дисахариди Мальтоза – з залишків 1 Метилювання Мальтоза є проміжний продуктом при гідролізі крохмалю.
Целобіоза Приймає участь в реакції срібного дзеркала, утворює залишки | ||||||||||||||||||||
|
| Поделиться: |

 2p
2p 
 - D – глюкози(глікозидний гідроксил) і 1
- D – глюкози(глікозидний гідроксил) і 1  - D – глюкози(по 4 положенню)
- D – глюкози(по 4 положенню)


