
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел 15. Гетероциклические соединенияСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Циклы в молекулах гетероциклических соединений построены не только из атомов углерода, но содержат один или больше атомов других элементов, гетероатомов. Чаще всего это атомы азота, кислорода и серы. Гетероциклические соединения распространены в природе. Они входят в состав хлорофилла и гемоглобина, многих биологически активных соединений (медикаментов), красителей. Гетероциклы могут быть насыщенными и ненасыщенными, т.е. иметь двойные и тройные связи, моноциклическими и полициклическими. Данный раздел посвящен гетероциклическим соединениям с одним гетероатомом, проявляющим, подобно бензолу, ароматический характер. Ароматичность пятичленных гетероциклов пиррола, фурана, тиофена с двумя сопряженными Фуран по своим химическим свойствам занимает промежуточное положение между сопряженными диенами и ароматическими соединениями. Он легко вступает в реакции диенового синтеза с диенофилами, например малеиновым ангидридом, и способен окисляться легче, чем тиофен. При действии минеральных кислот на молекулы фурана и пиррола протон кислоты присоединяется к гетероатому за счет его свободной электронной пары. Последняя при этом выключается из сопряжения с Ароматические свойства наиболее сильно выражены у тиофена. Он заметно устойчивее к действию кислот и окислителей и не реагирует с диенофилами. Атом серы в тиофене более инертен, алкилируется лишь в жестких условиях, не проявляет ацидофобности. Тиофен способен сульфироваться на холоду серной кислотой. Эта реакция используется для очистки от примесей тиофена бензола, который в этих условиях не сульфируется. Обратите внимание на методы получения фурана, тиофена, пиррола, а также на возможность взаимных превращений этих соединений:
Структура молекулы наиболее изученного ароматического гетероцикла из шести атомов – пиридина С5Н5N – напоминает структуру бензола. У них близки длины связей в циклах, углы между связями в обеих молекулах 120о. Но в отличие от неполярного бензола кольцо пиридина представляет собой диполь с большим электрическим моментом. Отрицательный заряд в нем сосредоточен на атоме азота, а положительный – на атомах углерода. Свободная р- электронная пара атома азота в образовании ароматического кольца не участвует, и его нуклеофильные свойства за счет этой пары полностью сохраняются. Он способен присоединять протон, галогеналкилы, галогены. В этих реакциях пиридин ведёт себя как основание – третичный амин. Дефицит электронной плотности на атомах углерода пиридинового кольца обуславливает его малую активность в реакциях электрофильного замещения (меньшую, чем у нитробензола) и повышенную активность в нуклеофильном замещении. В соответствии с распределением электронной плотности проявляется β-ориентация в первом случае и α-, Применение различных ароматических гетероциклических соединений и их производных в технике весьма разнообразно; ознакомьтесь с его основными направлениями.
|
|||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 417; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.254.202 (0.011 с.) |

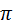 -связями и гетероатомом между ними объясняется делокализацией свободной р- электронной орбитали гетероатомов с образованием ароматического секстета электронов. При этом гетероатом значительно теряет способность к алкилированию, окислению.
-связями и гетероатомом между ними объясняется делокализацией свободной р- электронной орбитали гетероатомов с образованием ароматического секстета электронов. При этом гетероатом значительно теряет способность к алкилированию, окислению.
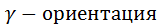 – во втором. Электрофильное замещение требует жестких условий и даёт невысокие выходы продуктов. Обратите внимание на легкость, в отличие от бензола, раскрытия кольца пиридина.
– во втором. Электрофильное замещение требует жестких условий и даёт невысокие выходы продуктов. Обратите внимание на легкость, в отличие от бензола, раскрытия кольца пиридина.


