
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Квантовая модель атома водорода
1. Квантовые числа. Уравнение Шрёдингера в задаче о движении электрона в электрическом поле ядра решается в трёхмерном пространстве в сферической системе координат. Координатами в этой системе являются радиус 0 ≤ r ≤ ∞, полярный угол 0 ≤ θ ≤ π, азимутальный угол 0 ≤ φ ≤ 2 π. Решение уравнения Шрёдингера представляет собой произведение трёх функций по трём независимым координатам, n – главное квантовое число. Оно входит в радиальную часть решения R (r) и определяет уровень энергии. Число n может принимать только целые положительные значения, n = 1, 2, 3,... l – азимутальное квантовое число. Оно входит в описание функции Ψ в широтном направлении. Число l может принимать целые положительные значения конечного ряда чисел, l = 0, 1, 2,... n – 1. Каждому энергетическому уровню с номером n соответствует n значений азимутального квантового числа l. m – магнитное квантовое число. Оно входит в описание функции Ψ в меридиональном направлении. Число m принимает 2 l +1 значений конечного ряда: m = 0, ±1, ±2, ±3, ±... ± l. Энергия электрона в атоме водорода зависит только от главного квантового числа n. Каждому разрешённому n -му уровню энергии соответствует несколько собственных функций Ψ, отличающихся набором значений квантовых чисел l и m. Это значит, что, будучи на одном и том же энергетическом уровне, атом водорода может находиться в нескольких разных состояниях. Состояния с одинаковой энергией называются вырожденными, а число разных состояний с одним значением энергии называется кратностью вырождения соответствующего энергетического уровня. Поскольку каждому из n значений квантового числа l соответствует 2 l +1 значений квантового числа m, то число разных состояний, соответствующих уровню n, равно
Отсюда следует, что невозбуждённый атом водорода на уровне n = 1 может находиться в одинаково возможном (основном) состоянии. Возбуждённому уровню n = 2 соответствует 22 = 4 возможных состояний, уровню n = 3 – 32 = 9 возможных состояний и т.д. Часто энергетические уровни обозначают большими буквами латинского алфавита. n = 1, K -уровень; n = 2, L -уровень; n = 3, M -уровень;
n = 4, N -уровень; n = 5, O -уровень; n = 6, P -уровень; n = 7, Q -уровень. Состояния с разными азимутальными квантовыми числами l обозначают малыми буквами латинского алфавита. Часть этих букв пришла из спектроскопии (первые буквы в названии спектральных серий щелочных металлов). l = 0, s -подуровень (от англ. sharp – резкий); l = 1, p -подуровень (от англ. principal – резкий); l = 2, d -подуровень (от англ. diffuse – размытый); l = 3, f -подуровень (от англ. fundamental – основной); l = 4, g -подуровень; l = 5, h -подуровень. Обычно состояние электрона в атоме обозначают так: 1 s -состояние, n = 1, l = 0. 2 s -состояние, n = 2, l = 0. 2 p -состояние, n = 2, l = 1. 3 d -состояние, n = 3, l = 2, и т.д. 2. Атом водорода в основном состоянии. Главное квантовое число n = 1. Квантовые числа l и m могут принимать единственные значения l = 0 и m = 0. Кратность вырождения n 2 = 12 = 1. Основное состояние (невозбуждённое) атома водорода единственно возможное. Функция Ψ представлена лишь радиальной составляющей,
Здесь r 1 – боровский радиус, Z = 1 – номер элемента водорода в таблице Менделеева. Но это значит, что На рис. 19 показана зависимость функции Ψ, а на рис. 20 – зависимость функции Если в качестве объёма атома брать объём, вероятность пребывания в котором электрона равна единице, то объём атома будет равен бесконечности. Поэтому договорились принимать в качестве объёма атома такой объём, вероятность пребывания в котором электрона составляет 0,9 (90%).
Выражение Из того, что подинтегральная функция не
Но трактовка одного и того же числа r 1 разная. В теории Бора r 1 – это радиус круговой орбиты, на которой электрон находится постоянно. В квантовой теории r 1 – это радиус сферы, вероятность пребывания в окрестности которой у электрона максимальна. Механический момент у электронного облака в 1 s -состоянии равен нулю. Из формулы (4.22)
Магнитный момент электрона в 1 s -состоянии также равен нулю. Из формулы (2.18)
[Для сравнения: в атоме Бора моменты не равны нулю. Энергия электрона получается такой же, как и в атоме Бора (ф. 2.13)
Здесь me – масса электрона. 3. Возбуждённый атом водорода на энергетическом уровне n = 2. Кратность вырождения 22 = 4.
l = 0. Первое (2 s) состояние отчасти повторяет предыдущее состояние 1 s. Электронное облако центрально-симметричное. Функции Ψ и Функция l = 1. На p -подуровне электрон может находиться в трёх состояниях, соответствующих m = 0, = ±1. Если OZ – ось, относительно которой отсчитывается полярный угол θ, а OX – ось, от которой отсчитывается азимутальный угол φ, то электронные облака в 2 p -состоянии располагаются, как показано на рис. 26. В состоянии m = 0 облако напоминает гантель, расположенную вдоль оси OZ. Состояния m = +1 и m = –1 отличаются тем, что функция Ψ имеет в противоположных областях разные знаки. Но квадрат модуля Механический момент электрона в 2 p -состоянии не равен нулю.
Проекция механического момента электрона на ось Z может принимать значения:
Магнитный момент электрона в 2 p -состоянии
Проекции магнитного момента электрона на ось Z могут принимать значения
Здесь me – масса электрона. 4. Возбуждённый атом водорода на энергетическом уровне n = 3. Кратность вырождения 32 = 9.
l = 0. Электронное облако в 3 s -состоянии центрально-симметричное. График радиальной плотности вероятности для 3 s -электрона показан на рис. 27. Максимумы кривой приходятся примерно на радиусы боровских орбит r 1 4 r 1 9 r 1. Две сферические узловые поверхности имеют приблизительно радиусы 2 r 1 и 7 r 1.
Механический и магнитный моменты 3 s -электрона равны нулю. l = 1. Форма облаков в 3 p -состоянии примерно такая же, как и в 2 p -состоянии (рис. 26). Но радиальная плотность вероятности меняется. Появляется одна узловая поверхность – сфера с радиусом 6 r 1 (рис. 28). Поэтому при m = 0 «гантель» распадается на две области: малую область внутри этой сферы и «гантель» вне этой сферы. При m = ±1 тор также распадается на две области. Маленький тор находится внутри сферы радиуса r = 6 r 1, большой – снаружи! Механический L и магнитный pm моменты электрона в 3 p -состоянии такие же, как и в 2 p -состоянии (формулы 5.5 и 5.6). l = 2. Форма облаков в 3 d -состоянии скромнее. Их конфигурации и сечения показаны на рис. 29. Облака в 3 d -состоянии на имеют узловых поверхностей. С дальнейшим ростом главного квантового числа n s -состояние всегда остаётся центрально-симметричным. Общая конфигурация электронных облаков в p, d, f... состояниях в основном исчерпывается фигурами рис. 29. 5. Опыты Штерна и Герлаха. Улучшение разрешающей способности спектральных аппаратов привело к началу 20-х годов к появлению проблемы, не находившей своего объяснения. Спектроскописты открыли тонкую структуру спектральных линий. Многие линии, которые при слабом разрешении считались одиночными (синглеты), при сильном разрешении оказались двойными (дублеты), тройными (триплеты) и даже с большим числом линий (мультиплеты). К этому времени (1921 г.) была основательно разработана теория Бора. Естественно, что с её помощью пытались объяснить в первую очередь спектры щелочных металлов, атомы которых были наиболее «водородоподобны». В центре атома щелочного металла находится остов – ион с зарядом + e, а вокруг этого иона движется слабо связанный с ним электрон. Объяснить спектральные дублеты щелочных металлов можно было тем, что орбитальный магнитный момент электрона взаимодействует с магнитным моментом остова. Поэтому возник вопрос: действительно ли водородоподобные атомы имеют магнитный момент и если да, то квантован ли он? В 1921 г. немцы Отто Штерн и Вальтер Герлах в прямых опытах доказали, что атомы имеют магнитный момент и что магнитный момент атомов квантован. В сосуде с высоким вакуумом с помощью диафрагм В создавался узкий атомный пучок элемента, испарявшегося в печи К (рис. 30). Пучок проходит через сильно неоднородное магнитное поле между полюсами N и S магнита.
Один из наконечников (N) имел вид призмы с острым ребром, а вдоль другого (S) была выточена канавка. После прохождения магнитного поля пучок оставлял след на фотопластинке P. Идея опыта была в том, что если атомы в пучке имеют магнитный момент, то в магнитном поле они должны вести себя как маленькие магнитики. В однородном магнитном поле на магнит действует вращающий момент, поэтому магнитный атом может изменять свою ориентацию. В неоднородном поле кроме момента на магнит действует ещё сила, при одной ориентации втягивающая его к ребру (в область большей магнитной индукции), при другой – к канавке (в область меньшей индукции). (См. Электричество, §14). Если магнитного поля нет, то на пластинке Р должна получаться узкая полоска осаждённых атомов. Если поле есть, а атом ведёт себя как классический маленький маятник со случайной ориентацией магнитного момента, то полоска на пластинке Р должна уширяться, оставаясь сплошной. Если же магнитный момент атома квантован, то полоска должна расщепляться на несколько полос в зависимости от числа квантовых состояний. Опыты проводились с атомами серебра Ag, водорода Н, лития Li и других щелочных металлов. Оказалось, что в случае атомов 1-й группы (Li, H, Ag) полоска расщеплялась на две симметрично расположенные полоски. Это говорит о том, что атомы 1 -й группы имеют магнитный момент и способны принимать две ориентации – по полю и против поля. В теории Бора это можно было объяснить наличием орбитального магнитного момента внешних электронов. Тем более вычисления показали, что магнитный момент атома водорода в опытах Штерна равен магнетону Бора. Но буквально через 3-4 года, когда на смену теории Бора пришла квантовая механика, стало ясно, что никакого расщепления атомы водорода и щелочных металлов давать не должны. По анализу Паули, сделанному в 1923 г., следовало, что магнитные моменты остовов атомов щелочных металлов равны нулю. А из решения уравнения Шрёдингера, полученного через три года, получалось, что внешний электрон в атомах водорода и щелочных металлов находится в s -состоянии, и его магнитный момент так же равен нулю. Откуда же взялся магнитный момент атомов в опытах Штерна? 6. Спин. В 1925 г. ответили на этот вопрос американцы Сэмюэль Гаудсмит и Джордж Юленбек. Они показали, что дублеты в спектрах и опыты Штерна и Герлаха можно объяснить, если предположить существование у электронов собственного механического и магнитного моментов. Идея спина оказалась очень плодотворной и быстро нашла признание. В начале полагали, что спин электрона обусловлен его вращением вокруг собственной оси. (Отсюда название от английского to spir – вращаться). Но расчёты показали, что линейная скорость движения поверхности шарика-электрона в несколько раз должна превышать скорость света. Поэтому пришлось отказаться от столь наглядного толкования. В настоящее время словом «спин» обозначают собственный механический момент элементарных частиц, имеющий квантовую природу. Спин задаёт пространственную ориентацию частицы.
Для определения состояния микрочастицы к трём квантовым числам n, l, m нужно добавить ещё одно – спиновое квантовое число s. Оказалось, что у электрона спиновое число может принимать только два значения, s = +1/2 и s = –1/2. Собственный (спиновый) механический момент электрона может иметь лишь одно единственное значение (см. ф. 4.22).
Проекция механического момента электрона на физическую ось z (например, линии магнитного поля в опытах Штерна) может принимать два значения (см. ф. 4.23).
Это в 2 раза меньше минимального значения. Из формулы (2.18) следует, что отношение орбитального магнитного момента М электрона к механическому L равно
Опыт показывает, что спиновое гиромагнитное отношение в 2 раза больше.
Отсюда спиновый магнитный момент электрона Появление 4-го квантового числа s (спинового) увеличивает число состояний электрона на n -ном энергетическом уровне. Поскольку спиновое квантовое число s может принимать только два значения, то и число максимально возможных состояний электрона увеличивается в 2 раза и равно 2 π 2. Таким образом, в 1 s -состоянии, например, максимальное число электронов не один,а два. В одном и том же центрально-симметричном облаке могут находиться в 1 s -состоянии два электрона с противоположными спинами. 7. Излучение и поглощение света атомом водорода. Как и в теории Бора, излучение и поглощение света атомом квантовая механика связывает с переходами электрона с одного энергетического уровня на другой. Из дискретности энергетических уровней вытекает линейчатая структура спектров. Опыт и теория показывают, что могут реализовываться не любые переходы электрона в атоме. Возможность перехода определяется правилами Бора. Их два. Для азимутального квантового числа l. Для магнитного квантового числа m. Что касается вероятности переходов электрона с одного уровня на другой, то решение уравнения Шрёдингера для электрона в центральном поле ядра не даёт ответа на этот вопрос. Все уровни представляются в смысле устойчивости равноценными. На каждом уровне электрон может находиться сколь угодно долго. Поэтому разные интенсивности спектральных линий не объясняются. Для объяснения самопроизвольных переходов электрона нужно кроме электрона в поле ядра учитывать одновременно и поле излучения. То есть решать задачу для системы, состоящей из атома и поля излучения. Такая квантовая теория излучения была построена в первой трети 20 века. Она смогла объяснить не только интенсивность спектральных линий, но и поляризованность излучения. На рис. 31 показана схема уровней энергии атома водорода и разрешённые пути перехода. Толщина линий соответствует вероятности перехода. В соответствии с правилом отбора по азимутальному квантовому числу Слева на рисунке показана энергия возбуждения атома в электронвольтах, отсчитываемая от основного 1 s -состояния. Длина волны на рисунке указана в ангстрёмах,
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-23; просмотров: 404; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.28.48 (0.039 с.) |
 , и потому включает в себя три целочисленные параметра – квантовые числа n, l, m. Их названия сложились исторически.
, и потому включает в себя три целочисленные параметра – квантовые числа n, l, m. Их названия сложились исторически. (5.1)
(5.1) (5.1)
(5.1) также зависит лишь от радиуса r. Электрон с равной вероятностью может быть обнаружен в любой точке сферы определённого радиуса. Говорят, электронное облако имеет центрально-симметричную форму.
также зависит лишь от радиуса r. Электрон с равной вероятностью может быть обнаружен в любой точке сферы определённого радиуса. Говорят, электронное облако имеет центрально-симметричную форму. (5.2)
(5.2) представляет собой элементарный сферический объём, Va и Ra – объём и радиус шара, вероятность пребывания в котором электрона равна 0,9 (рис. 21).
представляет собой элементарный сферический объём, Va и Ra – объём и радиус шара, вероятность пребывания в котором электрона равна 0,9 (рис. 21). следует, что для оценки вероятности пребывания электрона на разных расстояниях r в сферическом облаке более информативна не объёмная плотность вероятности
следует, что для оценки вероятности пребывания электрона на разных расстояниях r в сферическом облаке более информативна не объёмная плотность вероятности  (численно – вероятность в сферическом слое единичной толщины). Хотя функция
(численно – вероятность в сферическом слое единичной толщины). Хотя функция  нм.
нм. (5.3)
(5.3) (5.4)
(5.4)
 ].
].

 Электронное облако в обоих состояниях m = ±1 напоминает тор, образованный вращением знака ∞ (бесконечность) вокруг оси OZ. Оба облака вложены один в другой. На рис. 26 штриховкой показаны сечения изображающих электронные облака тел вращения плоскостью XOZ.
Электронное облако в обоих состояниях m = ±1 напоминает тор, образованный вращением знака ∞ (бесконечность) вокруг оси OZ. Оба облака вложены один в другой. На рис. 26 штриховкой показаны сечения изображающих электронные облака тел вращения плоскостью XOZ. (5.5)
(5.5)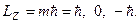 Здесь m = –1, 0, +1 – квантовое число.
Здесь m = –1, 0, +1 – квантовое число. (5.6)
(5.6)

 (5.7)
(5.7) (5.8)
(5.8) Орбитальное гиромагнитное отношение (5.9)
Орбитальное гиромагнитное отношение (5.9) Спиновое гиромагнитное отношение (5.10)
Спиновое гиромагнитное отношение (5.10) (5.11)
(5.11) (5.12)
(5.12) (5.13)
(5.13) запрещены переходы между одноимёнными подуровнями типа 2 s → 1 s, 3 p → 2 p, 4 d → 3 d и так далее. Поэтому на рисунке все линии переходов косые (прямые линии объединяют одноимённые подуровни).
запрещены переходы между одноимёнными подуровнями типа 2 s → 1 s, 3 p → 2 p, 4 d → 3 d и так далее. Поэтому на рисунке все линии переходов косые (прямые линии объединяют одноимённые подуровни). нм.
нм.


