
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периодическая система элементов Менделеева.Содержание книги
Поиск на нашем сайте
1. Периодическая система. В 1869г. Дмитрий Менделеев открыл закон, согласно которому свойства химических элементов изменяются периодически с ростом атомной массы элементов. В 1922г. Нильс Бор на основе созданной им теории строения атома показал, что в основе систематики элементов лежит не атомная масса, а электрический заряд ядра. Если e – элементарный заряд, то заряд ядра можно представить как Ze, где Z – число элементарных зарядов в ядре. Его называют также порядковым номером элемента. Поскольку атом в нормальном состоянии нейтрален, то в электронной оболочке атома, заряд ядра которого Ze, содержится Z электронов. 2. Заполнение периодической таблицы – это мысленный процесс построения модели многоэлектронного атома. На основе законов квантовой механики. В основе заполнения лежат три принципа. а. Водопроводность электронных конфигураций многоэлектронных атомов, Н. Бор, 1992г. Заполнение ведется с наиболее низких по энергии уровней в направлении возрастания энергии. В первую очередь реализуются те конфигурации электронных облаков, в которых энергия связи электронов с ядром максимальна. б. Принцип запрета Паули, 1925г. В атоме нет двух и более электронов, находящихся в одинаковом состоянии, то есть имеющих одинаковые наборы квантовых чисел n, l, m, s. Позднее выяснилось, что принцип запрета Паули справедлив для всех микрочастиц с полуцелым спином. Такие частицы называют фермионами. в. Правило Хунда (Фридрих Хунд, 1927г.). На подуровнях с одинаковой энергией электроны остаются по возможности неспаренными. 3. Первый период таблицы Менделеева, n =1. В соответствии с принципом запрета Паули на первом энергетическом уровне (в К - слое) может находиться не более 2 n 2 =2 электронов. Поэтому первый период таблицы составляют только два химических элемента – водород и гелий. Водород Н. Номер Z =1, заряд ядра Ze = e, в электронной оболочке находится один электрон в 1 s – состоянии. Механический L и магнитный pm орбитальные моменты электрона равны нулю, L =0, pm =0. Проекции спиновых моментов одного электрона, Lsz=ħ/z, pmsz=eħ/2me. Отдавая электрон в химических реакциях, атом водорода ведет себя как атом металла с валентностью N =1. Потенциал ионизации атома Н 13,54В. Гелий Не. Поскольку заряд ядра Z входит лишь в радиальную часть решения уравнения Шредингера (см. ф.5.1), то увеличение заряда ядра, влияя на размеры электронных облаков (уменьшает их), не сказывается на их конфигурации и расположении. Поэтому второй 1 s -электрон «идет» в атоме гелия в тоже центрально-симметричное облако, в котором уже находиться 1 s -электрон водорода. Чтобы выполнялся принцип запрета Паули, спины электронов должны быть противоположными. Поэтому сумма проекций спиновых моментов атома гелия обращается в нуль. В результате все моменты атома гелия – орбитальные и спиновые – равны нулю. К – слой заполнен полностью. Электронная оболочка гелия чрезвычайно устойчива. Потенциал ионизации гелия самый большой среди элементов и составляет 24, 45 В. поэтому гелий – инертный газ. Электронная конфигурация (формула) гелия 1 s 2. двойка справа от s показывает число электронов, находящихся в 1 s -состоянии. Читается формула «один эс два». 4. Второй период, n= 2. На втором энергетическом уровне (в L -слое) может находиться не более 2 n 2=2·22=8 электронов. Это значит, что во второй период таблицы Менделеева входят элементы с номерами Z от 3 (литий Li) до 10 (неон Ne). Литий Li. Номер Z =3 с увеличением заряда ядра до 3 е третий электрон «идет» в L – слой в 2 s – состояние. Поскольку все моменты 1 s 2 оболочки гелия равны нулю, то моменты атома лития определяются исключительно третьим электроном. Так как он находится в 2 s – состоянии, то его орбитальные моменты также равны нулю. Остаются только спиновые. Для атома лития в целом L =0, pm =0, Lsz=ħ /2, pmsz=eħ /2 me . Третий электрон лития находиться в поле ядра, экранированного двумя электронами К – слоя. Поэтому он слабо связан с ядром. Потенциал ионизации атома лития равен 5,37 В. Меньше его лишь потенциалы ионизации других щелочных металлов – натрия, калия, рубидия, цезия. При внешнем воздействии третий электрон легко отрывается, поэтому атом лития легко окисляется с валентностью N =1. объемы атомов щелочных металлов самые большие. Это хорошо видно на рис.32, где по вертикальной оси отложены объемы в см3 для разных элементов. Формула лития 1 s 22 s 1. Бериллий Ве, Z =4. В L – слое находится два электрона с противоположными спинами в 2 s – состоянии. Часто на схемах размещение электронов в электронных оболочках атомов изображают с помощью квантовых ячеек, как показано на рис.32. Формула бериллия 1 s 22 s 2. Все электроны спарены и находятся в s – состоянии. Поэтому все моменты атома равны нулю. За счет того, что внешние электроны в L – слое спарены (спины противоположны), по сравнению с литием потенциал ионизации атомов бериллия больше и равен 9,48 В. В химических реакциях менее активен. Способен окисляться (отдавать электроны) с валентностью N =2. Бор В, Z =5. С ростом числа электронов в атоме, ядро атома все более экранизируется электронной оболочкой. Поэтому для каждого последующего электрона поле ядра все больше отличается от кулоновского. Энергетические уровни в многоэлектронных атомах в отличие от атома водорода расщепляются. В значительной степени это происходит за счет роста орбитального механического момента электронов. Так, в L – слое (n =2) орбитальные моменты электронов в 2 s – состоянии равны нулю. А в 2 р – состоянии в том же слое орбитальный механический момент электрона E= (meu)2/2 me= L 2/2 me r 2= L 2/2 I. (6.1) Здесь I= me r 2 - момент инерции электрона относительно ядра. В результате 2 р – подуровень в L – слое энергетически оказывается выше 2 s – подуровня в том же слое. Поэтому вначале заполняется 2 s – состояние и лишь затем 2 р – состояние (рис.33). Моменты атома бора определяются моментами одного наружного 2 р – электрона. Хотя потенциал ионизации бора несколько меньше по сравнению с бериллием и равен 8,4 В, металлические свойства бора выражены слабее. Его валентность N =3. Формула бора 1 s 22 s 22 p 1.
От Бора до Неона (B à Ne) идет последовательное заполнение 2 р – подуровня. В соответствии с правилом Хунда 6-ой электрон в атоме углерода идет во вторую квантовую ячейку. Поэтому углерод может быть 2-х и 4-х валентен (рис.34). По мере заполнения 2 р – подуровня потенциалы ионизации атома растут. Поэтому атомы в химических реакциях все более способны присоединять электроны, чем их отдавать (рис.35). На неоне (Z =10) заканчивается заполнение L – слоя. Как и у гелия, полностью заполненный L – слой образует очень устойчивую электронную оболочку. Все моменты оболочки неона (1 s 22 s 22 p 6) равны нулю. Потенциал ионизации 21,5 В. Поэтому, как и гелий, неон – инертный газ. 5. Третий период, n =3. Как и второй он начинается со щелочного металла. Натрий Na, Z =11, сходен по своим свойствам с литием Li. Его одиннадцатый электрон размещается далеко от ядра в М – слое (n =3) в 3 s – состоянии. Объем атома самый большой среди элементов третьего периода (рис.32). Потенциал ионизации всего лишь 2,12 В. После натрия вплоть до аргона Ar (=18) подуровни заполняются в соответствии с теоретической схемой. Свойства элементов в третьем периоде изменяются так же, как и во втором, от типичного металла (Na) до типичного не металла хлора (Cl, Z =17). Теоретически аргон не завершает третий период. Ведь в М – слое должны находиться 2 n 2=2*32=18 электронов. А аргону – восьмому элементу в периоде соответствует всего лишь восьмой электрон. Если бы заполнение М – слоя шло далее в соответствии с теоретической схемой, то аргон оказался бы примерно в середине третьего периода (рис.36). Для завершения М – слоя нужно еще 10 электронов на 3 d – подуровень. Однако опыт в химии и спектроскопии показывает, что 19-й электрон «идет» не в 3 d – состояние, а в 4 s, давая тем самым начало новому периоду. Первые три периода называются малыми. Элементы, расположенные друг над другом, сходны по своим свойствам и образуют группы элементов. Первая слева группа (H, Li, Na) – группа щелочных металлов. Все ее элементы содержат во внешнем слое один электрон в s – состоянии. Элементы второй группы (Be, Mg) содержат по два электрона в s – состоянии, элементы третьей группы (B, Al) содержат по три электрона в s – и p – состоянии и т.д. Периодическое изменение числа электронов во внешнем слое и определяет в основном, периодичность свойств элементов в периодах. 6. Четвертый период, n =4. Расщепление энергетических уровней в многоэлектронных атомах с ростом номера слоя n оказывается столь значительным, что подуровни разных слоев начинают перекрываться. В результате нижний s – подуровень 4-го слоя оказывается ниже верхнего d – подуровня 3-го слоя (рис.37). Поэтому 19-му и 20-му электронам энергетически «выгоднее» разместиться не на 3 d, а на 4 s – подуровне. Получаются элементы калий К (z =19) и кальций Са (z =20) – типичные металлы с низкими потенциалами ионизации 4,32 и 6,09В. Лишь после этого заполняется 3 d -подуровень (10 электронов) со скандия Sc (z =21) до цинка Zn (z =30). Поскольку заполнение подуровней идет в глубине электронной оболочки, изменение свойств элементов менее выражено. Свойства этих элементов уже не соответствуют свойствам выше расположенных элементов предыдущих периодов. Чтобы спасти положение Менделеев разделил вертикальные столбцы-группы элементов на подгруппы. Главную подгруппу образуют элементы, начинающиеся с элементов малых периодов. Главная подгруппа щелочных металлов, главная подгруппа галогенов и др. В атомах элементов главных подгрупп на внешнем слое одинаковое число электронов. Побочные подгруппы образуют элементы, заполнение слоев которых идет в глубине. Менделеев предложил пространственно разделять подгруппы, сдвигая символ элемента в клетке периодической таблицы к левой или правой стороне (рис.38). Начиная с галлия (Ga, z =31) продолжается заполнение 4-го слоя (4 p -состояние). Когда вновь образуется устойчивая конфигурация 4 s 24 p 6 (инертный газ) криптон (Kr,z =36), заполнение 4-го слоя прекращается. Всего в 4-м слое должно быть 2 n 2=2·42=32 электрона. Но элементов в 4-м периоде только 18. Из них 10 образованы заполнением предыдущего 3 d -подуровня. Незаполненными в N -слое остались 4 d и 4 f - подуровни (рис.39). 7. Пятый период, n =5. Из-за перекрытия энергетических уровней 37-й и 38-й электроны “идут” в 5 s -состояние. Образуются типичные металлы рубидий Rb (z =37) и стронций Sr (z =38) с потенциалами ионизации 4,16 и 5,67В. В 10 элементах, с 39 (иттрий I) по 48 (кадмий Cd) идет заполнение 4 d -подуровня. С 49 (индий In) по 54 (ксенон Xe) идет заполнение 5 p -подуровня. В атоме ксенона с устойчивой конфигурацией внешней оболочки 5 s 25 p 6 остаются незаполненными не только подуровни 5-го слоя 5 d, 5 f и 5 q, но и подуровень 4 f 4-го слоя (рис.40). В 5-м слое должны находиться 2 n 2=2·52=50 электронов. Но элементов в 5-периоде таблицы Менделеева только 18. Из них 8 принадлежат 5-му периоду “на законных основаниях”, так как образованы заполнением 4 d -подуровня. 8. Шестой период, n =6. Здесь еще более сложное положение. После ксенона 55-й и 56-й электроны идут на 6 s -подуровень, в результате образуются металлы цезий (Cs, z =55)и барий (Ba, z =56). В атоме лантана 57-й электрон идет в 5 d -состояние, а у последующих 14 элементов (церий Се, z =58-лютеций Lu, z =71) электроны идут еще глубже, заполняя 4 f -состояние. Поскольку электроны идут в глубину оболочки, изменение свойств элементов проявляется очень слабо. Вся эта группа элементов, начиная с лантана, называется группой лантаноидов и сводится в отдельную строку периодической таблицы. После лантаноидов, начиная с гафния (Hf, z =72), продолжается заполнение предпоследнего слоя в 5 d -состоянии (Первый электрон в 5 d -состоянии у лантана, z =57, второй - у гафния, z =72, и далее до ртути Hg, z =80). От таллия Tl (z =81) до радона Rn (z =86) заполняется 6 p -подуровень, кончающийся устойчивой оболочкой инертного газа радона с конфигурацией 6-го слоя 6 s 26 p 6 (рис.41). 9. Седьмой период, n =7 завершает таблицу известных элементов. У франция Fr (z =87) и радия Ra (z =88) заполняется 7 s -подуровень. А начиная с актиния Ас (z =89) образуется группа из 14 элементов – актинидов, в атомах которых заполняется более глубокий 5 f -подуровень. Элементы имеющиеся в природе, заканчиваются ураном U (z =92). Все элементы, находящиеся дальше урана (z >=93), называются трансурановыми элементами. Все они радиоактивны и имеют период полураспада, который много меньше времени существования Земли. Поэтому в земной природе их нет (все распались). Некоторые трансурановые элементы, примерно до z =105, удавалось получить искусственно с помощью ядерных реакций. Однако элемента с оболочкой инертного газа пока среди них нет. Схема заполнения электронных оболочек атомов приведена в таблице 6.1. 10. Химическая связь. Впервые теоретически исследовали условия коллективизации двух атомов водорода в молекулу Вальтер Гайтлер и Фриш Лондон в 1927 году. Полученные ими результаты, а также результаты исследователей, полученные позднее, позволяют представить механизм образования молекул так. Все множество типов связей, различаемых в химии, можно разделить на две принципиально разные группы: ковалентная связь и ионная связь. а. Ковалентная связь образуется между схожими по химическим свойствам элементами: H 2, N 2, O 2, CN, CH 4. При сближении атомов их внешние энергетические уровни деформируются так, что электрон от одного атома может переходить к другому. Если спины электронов в перекрывающихся облаках противоположны, то энергия системы из двух атомов оказывается меньше, чем сумма энергий двух отдельных атомов. В результате атомы соединяются в молекулу, а внешние электроны коллективизируются. Они одинаково принадлежат обоим атомам. Внешние энергетические слои атомов насыщаются при этом до электронных оболочек инертных газов. Например, у молекулы водорода H 2 получается оболочка гелия, у молекулы метана CH 4 – оболочка неона, у молекулы арсина AsH 3 – оболочка криптона (рис.42). Если молекула образуется из одинаковых атомов (H 2, O 2, N 2), то она симметрична, если из разных (CN) - асимметрична. В случае соударения атомов, внешние электроны которых имеют параллельные спины, энергия системы оказывается больше суммы энергий отдельных атомов. Между атомами возникает отталкивание, они расходятся. В целом, химически активными, то есть валентными электронами оказываются лишь те, которые не парны по спину. У водорода это один электрон в 1 s -состоянии, у лития – один электрон в 2 s -состоянии. У бериллия два внешних электрона в 2 s -состоянии спарены. Но при достаточной энергии возбуждения один электрон переходит 2 p -состояние, в результате получаются два неспаренных электрона. б. Ионная связь образуется между атомами элементов, расположенных в противоположных концах периодов (NaCl, KBr). При образовании молекулы поваренной соли NaCl, например, слабо связанный 3 s -электрон натрия захватывается М -оболочкой хлора, которая насыщается до инертной оболочки аргона. В результате образуются два иона с оболочками инертных газов. Ион Na +, оболочка неона Ne, и ион хлора Cl -, оболочка аргона Ar. Энергия, затрачиваемая на извлечение 3 s -электрона из атома Na и включение его в атом Cl, компенсируется энергией, которая выделяется при сближении пртивоположно заряженных ионов Na + и Cl -. В результате возникает устойчивая электростатическая система NaCl (рис.43).
|
||||
|
Последнее изменение этой страницы: 2017-01-23; просмотров: 386; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.10.80 (0.011 с.) |

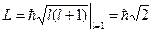 . Так как L=meu r, то meu= L/ r. Отсюда приращение энергии
. Так как L=meu r, то meu= L/ r. Отсюда приращение энергии


