
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимодействие быстрых электронов с веществомСодержание книги
Поиск на нашем сайте 1.Столкновение электронов с конденсированным веществом имеет, как правило, неупругий характер. Сталкиваясь с кристаллической решеткой твердого тела или с жидкостью, электрон тормозиться, сбрасывая энергию своего движения в виде тормозного электромагнитного излучения. При скорости движения u до 1км/с излучаются электромагнитные волны метрового и сантиметрового диапазонов с l ³ 1см. При скорости в пределах от 1км/с до 670км/с излучаются электромагнитные волны миллиметрового и ИК диапазонов. Более высокие скорости движения электроны приобретают уже не в результате теплового взаимодействия с частицами газовой среды, а разгоняясь в электрических полях. Кинетическую энергию электрона в таких случаях удобнее выражать через напряжение U ускоряющего поля, исходя из условия: eU=mu 2/2, где e – заряд электрона, m – его масса. Скорости 670км/с соответствует напряжение 1,4 вольт. Обычно говорят, электрон с энергией 1,4 электрон-вольт. Если энергия электрона составляет от 1,4 до 124эВ, то при торможении он испускает фотоны в видимом и УФ диапазонах. При дальнейшем нарастании энергии вплоть до 20кэВ тормозящийся электрон испускает кванты ЭМ энергии в рентгеновском диапазоне. Во всех рассмотренных случаях, когда энергия электрона меньше 20кэВ, при гашении его скорости испускается тормозное излучение со сплошным спектром. Коротковолновая граница спектра l min определяется энергией электрона. eU= Когда энергия электрона достигает значений 30 и более кэВ, он оказывается способным проникнуть внутрь электронной оболочки атома и возбудить расположенные в его глубине энергетические уровни. В результате атом излучает кванты ЭМ энергии не с внешних, оптических, в обычном смысле, уровней, а из глубины. Поэтому на фоне сплошного тормозного спектра появляются узкие линии характеристических рентгеновских лучей. Приходя из внутренних областей атома, они несут информацию об его структуре. Скорости движения электронов могут достигать очень больших величин вплоть до 0,999 скорости света в вакууме. Поэтому, влетая с такой скоростью в диэлектрическую жидкость или в диэлектрический кристалл, они какое-то время движутся со скоростью, большей фазовой скорости света в данном веществе, u > с/n. Здесь n – показатель поглощения среды. В результате возникает специфический эффект – свечение Вавилова-Черенкова. Эти два явления – характеристические рентгеновские лучи и свечение Вавилова - Черенкова и рассматриваются в данном параграфе. 2.Рентгеновская спектроскопия. Для исследования рентгеновских спектров (спектров Х - лучей) нужен спектрометр – прибор, позволяющий не только регистрировать факт излучения в рентгеновском диапазоне, но и измерять длину волны l (частоту n) этого излучения. В основе рентгеновской спектрометрии лежит дифракция Х – лучей на кристаллах (см. Оптика, §34). Исторически были разработаны три практических метода. а. Метод Лауэ, 1912г. Реализуется в проходящих лучах. Узкий пучок Х – лучей, выделяемый отверстием в свинцовом экране, проходит через монокристалл К, играющий роль пространственной дифракционной решетки (рис. 55). В методе Лауэ используются Х – лучи со сплошным тормозным спектром. Поэтому всегда находятся лучи тех длин волн, для которых выполняется условие главных максимумов в проходящих лучах. В результате на фотопластинке Фп, расположенной за кристаллом, образуется система точечных почернений. На рис. 56 показана фотография дифракционной картины Х – лучей на кристалле кварца, полученная по методу Лауэ (лауэграмма). По мере удаления от центра длина волны Х – лучей меняется. Поэтому в принципе лауэграммы можно использовать для определения длин волн l рентгеновского излучения. Однако расшифровка лауэграмм очень кропотливое и труднейшее дело. б. Метод Вульфа-Брэггов,1912г. Реализуется в отраженных лучах. Если на поверхность монокристалла направить пучок монохроматических Х – лучей, то при некоторых углах скольжения q будет выполняться условие главных максимумов в отраженных лучах (рис. 57). 2 d sin q = kl. Формула Вульфа-Брэггов,1912. (9.2) Схема установки показана на рис. 58. Пучок лучей из рентгеновской трубки падает под углом скольжения q на грань монокристалла К и отражается под тем же углом. Столик с кристаллом медленно поворачивается. Вокруг кристалла по дуге окружности расположена фотопластинка Фп. Когда угол q соответствует условию главного максимума (9.2), в отраженных Х – лучах возникает дифракционная вспышка, в результате на фотопленке в этом месте остается спектральная линия. Если пучок лучей монохроматический, то спектральные линии имеют примерно одинаковую интенсивность и располагаются на фотопластинке в соответствии с формулой (9.2) симметрично оси падающего на кристалл луча. Процесс исследования ускоряется, если вместо фотопластинки использовать ионизационную камеру, расположенную на отраженном луче и движущуюся по дуге с удвоенной угловой скоростью. (Дело в том, что при повороте зеркала-кристалла на угол a отраженный луч поворачивается на угол 2 a). В этом случае спектральным линиям соответствуют всплески электрического тока, пропорциональные интенсивности линий. Эти всплески регистрируются на самописце или в памяти ЭВМ. Метод Вульфа - Брэггов лежит в основе большинства рентгеновских спектрометров, которые в принципиальной своей части повторяют схему рис.58. в. Метод Дебая - Шерера. В 1916г. немецкие физики Пауль Дебай и Петер Шерер предложили метод кристаллических порошков. Вместо качественного монокристалла, на котором осуществляется дифракция Х – лучей в первых двух методах, здесь используется спрессованный в цилиндрический столбик мелкокристаллический порошок (рис. 59). Если через такой столбик пропустить пучок монохроматических Х – лучей, то среди множества кристалликов в столбике всегда найдутся такие, которые расположены по отношению к лучу под углом, удовлетворяющим условию (9.2) для данной длины волны l. В результате возникает система лучей – конусов с углом при вершине 2 q, соответствующих дифракционным максимумам (рис.60). Если окружить столбик фотопленкой, как показано на рис. 59, то эти конусы оставляют на пленке следы в виде кривых линий, каждая из которых соответствует определенной длине волны l и порядковому номеру к максимума. Огромное преимущество метода Дебая – Шерера в простоте технологии приготовления образцов. Поэтому он широко применяется в рентгеноструктурном анализе. Именно этот метод лежит в основе опытов Дж.Л.Томсона по дифракции электронов (см. с.). 3.Рентгеновские спектры. В первое десятилетие 20 века было выполнено большое число работ по изучению рентгеновские спектры спектров. Оказалось, что по сравнению с оптическими спектрами рентгеновские спектры элементов много проще. Если оптические спектры элементов имеют сотни и даже тысячи (железо, Fe) спектральных линий, то рентгеновские спектры имеют 1-3 группы (серии) по несколько единиц линий в каждой. Число серий увеличивается с ростом порядкового номера z элемента в таблице Менделеева. На рис. 61 сравниваются спектры рентгеновских лучей элементов с порядковыми номерами (сверху вниз) z = 11, 14, 17, …80. По горизонтальной оси (вдоль спектров слева направо) отложена длина волны l от 0 до 2,6 нм. Спектры легких элементов с z от 11 (Na, натрий) до 22 (Ti, титан) имеют одну серию, спектры средних элементов с z от 23 (V, ванадий) до 62 (Sm, самарий) имеют по 2 серии, спектры тяжелых элементов, начиная с редкоземельных (z > 63) имеют по 3 серии и более. Группы самых высокоэнергичных линий с наименьшими длинами волн l (на рис. 61 крайние левые) стали обозначать буквой К (К - серия), следующие – буквами L (L - серия), М, N… Серии М и N имеются только у тяжелых элементов. Из всех серий наиболее простую структуру имеет К – серия. Она состоит из трех линий Кa, Кb, Кg. Линия Кa самая длинноволновая и самая яркая. При высоком разрешении некоторые линии оказываются дублетами. 4. Закон Мозли. Уже при общем сравнении спектров на рис. 61 становится ясно, что в расположении одноименных спектральных серий у разных элементов проявляется некоторая закономерность. Кривые, на которых располагаются серии, напоминают ветви параболы. В 1914г. Генри Мозли установил, что в отличие от оптических спектров многоэлектронных атомов, которые хорошо описываются формулой Ридберга (7.6) с поправками у квантовых чисел n и m, для рентгеновских спектров лучше подходит формула Бальмера с поправкой на атомный номер z элемента.
Здесь s - поправка (постоянная экранирования), мало отличающаяся от 1; n и m – главные квантовые числа, то есть номера энергетических уровней, соответствующих переходу электрона в атоме при испускании данной спектральной линии. Открытая Мозли закономерность (закон Мозли) имеет принципиальное значение. Закон Мозли утверждает, что квадратный корень из обратной длины волны линии одноименной спектральной серии пропорционален порядковому номеру элемента z. Для головной линии Кa формула (9.2) принимает вид:
Для линии Кb m = 3, для линии Кg m = 4. К - серия напоминает серию Лаймана в спектре атома водорода. Излучение квантов ЭМ энергии в К - серии возникает при переходе электрона на первый, самый низкий энергетический уровень (n = 1) со 2-го (Кa), с 3-го (Кb), с 4-го (Кg) уровней. Для L - серии формула закона Мозли имеет вид:
Энергия квантов L - серии меньше, а длина волны l больше, чем соответствующих линий в К - серии. L - серия аналогична серии Бальмера в спектре атома водорода. Для М - серии:
На рис. 62 показана диаграмма Мозли – график, где по вертикальной оси отложены значения С уменьшением номера z элементов длина волны l ЭМ излучения увеличивается и постепенно выходит из рентгеновского в УФ и видимый диапазон. Граница между рентгеновским и УФ диапазонами условна. Если принять для верхней границы рентгеновского диапазона l = 10нм, то из формулы (9.3) можно определить номер z элемента, начиная с которого и ниже электронная оболочка атома не может излучать рентгеновские лучи. Водород, гелий, литий, бериллий в принципе не могут излучать рентгеновские лучи по причине малой энергии атомов в возбужденном состоянии, реально доступная для измерений К - слоя появляется у элементов, начиная с натрия, z = 11. Другие серии появляются у еще более тяжелых элементов. 5. Механизм возникновения рентгеновских спектров состоит в том, что свободный быстрый электрон, влетающий в атом, выбивает из атома его собственный электрон с низкого энергетического уровня. Если “свой” электрон выбит с К - слоя, то в К - слое образуется вакансия. Какой-либо выше расположенный электрон атома, занимая вакансию, излучает квант К - серии. Если электрон выбивается с L - слоя, получается L - серия и т.д. Характеристические рентгеновские лучи имеют важное теоретическое и практическое значение. Их теоретическое значение состоит в том, что выходя из глубин атома, они несут информацию о внутреннем строении атома. Исторически закон Мозли сыграл большую роль в уточнении таблицы Менделеева, в частности, в распределении редкоземельных элементов. Практическое значение рентгеновских спектров в том, что они представляют собой надежное средство химического анализа веществ. В отличие от оптических спектров, генерируемых внешней оболочкой атома и меняющихся при вступлении атома в разные химические соединения, рентгеновские спектры практически не зависят от межатомных связей. Рентгеновский спектр сложного вещества есть сумма спектров составляющих его элементов. 6. Излучение Черенкова. В начале 20 века работавшая с радиоактивными материалами Мария Кюри наблюдала слабое свечение растворов солей радия. Она истолковала это свечение как люминесценцию раствора под действием радиоизлучения. (Подобно вспышкам сернистого цинка ZnS под действием a - частиц в спинтарископе Крукса.) В 1934 году Павел Черенков, работавший под руководством Сергея Вавилова над проблемой свечения растворов под действием g - излучения радия, установил, что растворы действительно люминесцируют. Но наряду с люминесценцией растворов существует еще дополнительное излучение, которое под действием g -лучей возникает и в чистых растворителях – воде H 2 O, бензоле C 6 H 6 и др. Глубокое исследование этого явления показало, что свечение чистых растворов вызывается не самими g -лучами, а быстрыми электронами, выбитыми g - квантами из атомов вещества. Излучение имеет определенное направление в пространстве, связанное с направлением движения электронов. Тогда как люминесценция излучается по всем направлениям равномерно. В 1937 году Илья Франк и Игорь Тамм разработали строгую теорию излучения Черенкова. В соответствии с этой теорией, подтвержденной опытом, излучение возникает в результате интенсивной локальной поляризации вещества диэлектрических жидкостей, обусловленной быстрыми электронами, скорость которых u больше фазовой скорости света в этом веществе, u >с/n. Здесь n- показатель преломления жидкости. 7. Природа излучения Черенкова. Когда электрон движется в диэлектрической жидкости, оказавшиеся вблизи от него молекулы поляризуются (рис. 63, слева). Буквой e на рисунке обозначен электрон, АВ – направление его движения. При медленном движении электрона поляризация молекул имеет не только осевую симметрию относительно траектории его движения, но одинакова спереди и сзади. В результате смещения поляризационных зарядов возникает электромагнитный импульс. Направленный в начале в одну сторону, а при исчезновении поляризации после прохождения электрона – в другую. Хотя эти импульсы не совпадают по времени, суммарный импульс на большом расстоянии от электрона оказывается довольно слабым. Поскольку электрон движется медленно, то возбуждаемые поляризацией волны не образуют единого волнового фронта (рис. 63 справа). В результате излучения получается очень слабым, равномерным по всем направлениям. Ситуация существенно меняется, когда скорость электрона больше фазовой скорости света в веществе. В этом случае релаксация молекул происходит уже после ухода электрона. Симметрия поляризации спереди - сзади нарушается (рис. 64, слева). Импульс электромагнитного излучения усиливается. (Качественно это видно хотя бы из того, что сопротивление движению электрона из-за несимметричной поляризации увеличивается.) А благодаря тому, что скорость электрона больше фазовой скорости света, u >с/n, у поляризационного излучения возникает единый волновой фронт ВС, направленный под углом q к вектору скорости Если путь АВ электрон проходит за время t, АВ = u t, то за это же время свет с фазовой скоростью с/n пройдет расстояние АС = (с/n)· t. Если среда изотропна (не кристалл), то угол между лучом АС и фронтом ВС прямой. Поэтому cos q = Излучение Черенкова формируется в узком коническом слое с углом при вершине 2 q. За счет этой направленности возникает усиление интенсивности излучения. На рис. 65 слева показана схема опыта Черенкова, поставленного им в Дубне в 1959 году. В качестве источника быстрых заряженных частиц использовался протонный ускоритель с энергией протонов 660 МэВ. На оси конуса излучения ставилась фотопластинка Фп. На полученной фотографии (рис. 65 справа) центральное светное пятно образовано прямым пучком протонов, прошедших сквозь жидкость. Излучение Черенкова образовало кольцо. Поскольку угол 2 q при вершине светового конуса зависит от скорости заряженных частиц, то на основе излучения Черенкова построены черенковские счетчики, позволяющие регистрировать быстрые заряженные частицы и определять их энергию. Люминесценция 1. Люминесценция (от лат. lumen – свет и … escent – суффикс, означающий слабое действие) – излучение, избыточное над тепловым и продолжающееся в течение времени, которое много больше световых колебаний. Первая часть определения отделяет люминесценцию от теплового равновесного излучения. Тепловое излучение в видимой области спектра заметно только при температуре около тысячи и более градусов. В то время как люминесценция может наблюдаться при любой температуре вплоть до абсолютного нуля. Поэтому люминесценцию называют часто холодным свечением. Вторую часть определения – признак длительности свечения – ввел Сергей Вавилов, чтобы отделить люминесценцию от разных видов рассеяния и отражения света, а также от тормозного излучения и излучения Черенкова. В отличие от расстояния света при люминесценции между поглощением и испусканием света происходят промежуточные процессы, длительность которых больше периода световой волны. Первоначально понятие люминесценция относилось только к видимому свету. В настоящее время оно применяется к излучению в ИК, видимом, УФ и рентгеновском диапазонах. Исторически явление люминесценции сыграло важную роль в развитии физики. Интерес к свечению разных веществ под действием катодных лучей привел К. Рентгена к открытию в 1895 году рентгеновских лучей. В 1896 году А. Беккерель, в продолжение семейной традиции занимавшийся изучением люминофоров, открыл естественную радиоактивность. Многие формы природной люминесценции были известны людям очень давно. Например, свечение насекомых (светлячки), свечение морских рыб и планктона, полярные сияния, свечение минералов, гниющего дерева и других разлагающихся органических веществ. Однако систематическое изучение люминесценции началось с конца 19 века. В настоящее время к природным формам прибавилось много искусственных способов возбуждения люминесценции. Твердые и жидкие вещества, способные люминесцировать, называют люминофорами (от лат. lumen – свет и греч. phoros - несущий). Чтобы вещество было способно люминесцировать, его спектры должны иметь дискретный характер, то есть его энергетические уровни должны быть разделены зонами запрещенных энергий. Поэтому металлы в твёрдом и жидком состоянии, обладающие непрерывным энергетическим спектром, не дают люминесценции. Энергия возбуждения в металлах непрерывным образом переходит в тепло. И лишь в коротковолновом диапазоне металлы могут испытывать рентгеновскую флуоресценцию, т.е. под действием рентгеновского излучения испускать вторичные Х -лучи. 2. Способы возбуждения люминесценции. Их много. Перечислим основные: а. Фотолюминесценция возбуждается светом. В зависимости от того, как быстро атом, поглотивший фотон hn 0, возвращается в стационарное состояние, испуская фотон hn, различают флуоресценцию (время релаксации t» 10-8с) и фосфоресценцию (t>> 10-8с). Деление это условно и носит практический характер. Вещества, с длительным послесвечением называют фосфорами. б. Радиолюминесценция возбуждается проникающей радиацией. Например, при движении частицы в кристалле сернистого цинка ZnS возникает локальная вспышка – сцинтилляция. Это явление лежит в основе сцинтилляционных счётчиков. Исторически первым таким счётчиком был построен в 1903 году спинтарископ Крукса. Сцинтилляционные счётчики позволяют регистрировать и сосчитывать ионизирующие частицы поштучно. В качестве радиолюминофоров в них используются кристаллы антрацена C 14 H 10, ZnS, Naj, Csj, органические растворы и пластики. К радиолюминесценции относится также свечение кристаллов под действием Х -лучей. Это делает возможной рентгеновскую диагностику на основе флюорографии – фотографирования на плёнку люминесцентного изображения просвечиваемого Х -лучами объекта (рис.66). В рентгеноскопии применяют люминофоры на основе (ZnCd) S·Ag и CaWO 4, дающие свечение в области максимальной чувствительности глаза и позволяющее максимально использовать чувствительность фотоплёнки, уменьшая тем самым дозу облучения. в. Катодолюминесценция возбуждается быстрыми электронами. Формально она может быть отнесена к радиолюминесценции, но благодаря её большому техническому значению обычно выделяется в отдельную группу. Катодолюминесценция применяется в экранах кинескопов телевизоров, осциллографов, мониторов ЭВМ. Для цветных кинескопов разработаны люминофоры, дающие три основные цвета свечения: синий (ZnS·Ag), зелёный (ZnSe·Ag), красный [ Zn 3(PO 4)2· Mn ]. г. Из других способов возбуждения люминесценции назовём триболюминесценцию – возбуждение свечения под действием механических деформаций (при раскалывании куска сахара в темноте наблюдается голубоватая вспышка), хемилюминесценцию – возбуждение за счёт энергии химических реакций. Хемилюминесценция в живых организмах сопровождающаяся видимым свечением, называется биолюминесценций. Последняя наблюдается у некоторых бактерий, грибов, насекомых и рыб. Биолюминесценция связана с процессами жизнедеятельности организмов. Более широко она распространена среди обитателей морей и океанов. 3. Фотолюминесценция. Резонансное излучение. Рассмотрим подробнее свечение тел возникающее под действием света. В 1904 году Роберт Вуд освещал пары натрия светом от горелки, в пламя которой вводилась поваренная соль NaCl. Благодаря этому в свете горелки присутствовали интенсивные D – линии натрия c l 1=589,6 и l 2=589,0 нм. Оказалось, что освещаемые пары натрия начинали светиться, испуская эти же D – линии с длинной волны l 1 и l 2. Такое же излучение Вуд наблюдал и в парах ртути Hg, освещаемых ртутной лампой. Как в свете лампы, так и в излучении паров Hg наблюдалась линия с l =253,7нм, расположенная в УФ области. Этот эффект назвали резонансным излучением. Название вытекает из классического толкования эффекта. Атом возбуждается частотой равной частоте собственных колебаний и испускает линию этой частоты. Резонансное излучение представляет собой частный и наиболее простой случай фотолюминесценции без энергетических потерь. Атом поглощает фотон hn, переходит в возбуждённое состояние и спустя какое-то время, излучает это же фотон hn. 4. Закон Стокса. Ещё в 1852 году Джордж Стокс, исследуя явление фотолюминесценции установил правило: длина волны фотолюминесценции больше длины волны возбуждающего света. Закон Стокса можно объяснить тем, что каждый испущенный при люминесценции фотон получается за счёт поглощённого фотона, часть энергии которого А растрачивается на какие-то внутримолекулярные процессы. Так что hn= hn 0- A. Величина А в большинстве случаев положительна (А >0, стоксовская область). Но иногда бывает отрицательной (А <0, антистоксовская область). В последнем случае к энергии возбуждающего фотона hn 0 добавляется тепловая энергия А колебательного движения молекул. В результате энергия hn излучённого фотона получается больше энергии hn 0 поглощённого фотона. С ростом температуры антистоксовская область выступает яснее. Закон Стокса был открыт на заре спектрального анализа, когда призменные и дифракционные спектральные аппараты имели малое разрешение. В результате не только свет возбуждения, но и свет люминесценции представлялся в виде широких цветных полос. Поэтому закон Стокса имел, в основном, такой смысл: фиолетовый свет может возбуждать, например, зелёное свечение, но зелёный свет не может возбуждать фиолетовое свечение. 5. Молекулярные спектры. В 1905 году Вуд провёл опыты с парами йода по той же схеме, что и опыты с парами натрия и ртути. Выбор элементов для исследования объяснялся тем, что натрий, ртуть, йод легко испаряются при относительно слабом нагревании. Небольшое количество этого вещества поглощалось в эвакуированную кварцевою ампулу, находившуюся в нагревательной печи (Рис.67). Меняя температуру в печи, можно изменять давление паров вещества в кварцевом сосуде. Наблюдение люминесцентного излучения велось обычно в направлении, перпендикулярном к возбуждающему пучку. В отличие от ртути и натрия, пары йода находятся в молекулярном состоянии I 2. Как уже говорилось в §7, число уровней энергии в молекулах много больше, чем в атомах. Исследование спектра люминесценции паров I 2 показала, что при освещении I 2 узкой линией спектра ртути с l =253,7 нм спектр паров I 2 представляет собой группы полос из тесно расположенных линий. Расстояние между линиями примерно 0,2 нм. Если длину волны возбуждающего света изменить на 0,4 – 0,8 нм, то вся система линий смещается в одну сторону, оставаясь в основном подобной. Это можно объяснить тем, что при изменении энергии поглощаемого фотона с hn 1 до hn 2 молекулы йода переходят на другой возбуждённый уровень. На рис.68 римской цифрой I обозначен нижний невозбуждённый электронный уровень в атоме йода (p - подуровень), цифрой II – ближайший возбуждённый электронный уровень атома йода (d - подуровень). Система пронумерованных уровней 0,1,2… показывает расщепление электронных уровней в молекуле йода, обусловленное колебательным движением молекулы. Линии без номеров между колебательными уровнями обозначают расщепление, обусловленное вращательным движением молекулы. Уровни расположены очень тесно, энергетические ступеньки между ними малы. Поэтому даже незначительное изменение энергии поглощённого фотона с hn 1 до hn 2 переводит молекулу на другой возбуждённый уровень. Поскольку возвращается молекула в основное состояние в соответствии с правилами отбора, то “идёт” она по другим ступенькам, испуская хотя и похожую, но другую комбинацию спектральных линий. Чем уже линия возбуждающего света, тем лучше разрешается молекулярный люминесцентный спектр. Если возбуждающая линия становится шире, охватывая спектр частот от n 1 до n 2, то могут испускаться и первая и вторая (по рис.68) и другие системы полос. В результате спектр паров даже двуатомных молекул чрезвычайно усложняется и во многих местах становится малодоступным для разрешения. Спектры многоатомных молекул отличаются ещё большей сложностью, и потому их ещё труднее интерпретировать. Из рисунка 68 становится понятным закон Стокса. Если молекула не вносит энергию в излучение, то фотоны испускаемого света имеют меньшую энергию (большую длину волны) по сравнению с фотонами поглощаемого света (переходы а, б, в, г). Остальная энергия превращается в тепло и лишь при резонансном излучении, когда нет потерь энергия поглощённого и излучённого фотонов одинакова (переходы д). Если фотон поглощается уже возбуждённого за счёт колебательного или вращательного движения молекулой, то может излучаться фотон с большей энергией. Чем выше температура газа, тем больше таких возбуждённых молекул, тем больше вероятность антистоксовского излучения. Линии люминесцентных спектров уже линий теплового излучения, поскольку температура газа ниже и потому доплеровское уширение, обусловленное тепловым поступательным движением молекул, меньше. При сжатии газов расстояние между молекулами уменьшается. Их взаимодействие усиливается. Это ведёт к дополнительному расщеплению энергетических уровней молекул и, соответственно, к увеличению числа спектральных линий. 6. Люминесценция конденсированных сред. Её исследование затрудняется тем, что на раду с люминесцентным излучением в жидкости и газах становится весьма заметным рассеяние возбуждающего люминесцентного света. Чтобы устранить рассеянный свет, наблюдение ведётся обычно по схеме скрещённых светофильтров, показанной на рисунке 69. Источник возбуждающего света, например, электрическая дуга, заключён в светонепроницаемый кожух. Перед выходным объективом фонаря помещается светофильтр, максимум пропускания которого приходится на длину волны l 1, находящуюся в пределах полосы поглощения люминофора. Чтобы отсечь рассеянный в кювете К (или в кристалле) свет l 1, между глазом и кюветой помещается второй светофильтр Ф 2, длина волны l 2 максимума пропускания которого приходится на полосы люминесценции. Расстояние между спектральными линиями в полосах люминесценции конденсированных тел ещё меньше, чем в полосах молекулярных газов. Поэтому спектры люминесценции жидких и твёрдых тел обычно характеризуют кривой люминесценции. Опыт показывает, что кривые поглощения и люминесценции всегда сдвинуты друг относительно друга в соответствии с правилом Стокса и частично перекрываются (Рис.70). При возбуждении люминесценции узкой линией спектр люминесценции один и тот же, если линия находится в пределах полосы поглощения. Введение посторонних веществ в люминофор, ослабляющих свечение, называют примесным тушением люминесценции. Примесное тушение обусловлено тем, что возбуждённые атомы люминофора, сталкиваясь с атомами или молекулами примеси отдают им свою энергию. При концентрационном тушении свечение ослабляется из-за увеличения взаимодействия между самими излучающими атомами. В результате увеличивается вероятность безызлучательных переходов. Люминесценцию характеризуют коэффициентом полезного действия h=Е люм/ Е погл, где Е люм – энергия люминесцентного излучения, а Е погл – энергия поглощённого излучения, квантовым выходом k=n люм/ n погл, где n люм и n погл– число испущенных и поглощённых, соответственно, фотонов, средней длительностью t возбуждённого состояния молекул и др. Время t изменяется от 10-8с (пары йода) до 10-4с (урановые стёкла) и даже до нескольких часов. Из закона сохранения энергии следует, что чем больше t, тем меньше интенсивность свечения. С ростом температуры время t уменьшается. Кристаллофосфоры с t порядка нескольких часов могут высвечиваться при нагревании за доли секунды. Яркость свечения при этом сильно возрастает. 7. Люминесцентные лампы – это самая широкая область практического применения люминесценции. Схема включения самой распространённой газоразрядной ртутной люминесцентной лампы (ЛЛ) низкого давления показана на рис.71. Лампа ЛЛ представляет собой стеклянную трубку, на внутренней поверхности которой напылён мелкий порошок кристаллического люминофора. В торцах лампы впаяны вольфрамовые оксидированные спирали, облегчающие запуск лампы. Внутри лампы ЛЛ находится смесь ртутных паров Hg и инертных газов (Ne, Ar) под давлением 10-3÷10-2мм рт.ст. Возникающее в электрическом разряде лампы свечения ртутных паров около 50% по энергии находится в УФ области с интенсивными линиями l 1=184,9 и l 2=253,7нм, которые и обеспечивают свечение люминофора. При включении лампы ЛЛ в сеть 220 В ток через неё в начале не идёт. В результате на неоновой лампе – стартёре НЛ возникает напряжение, достаточное для её зажигания. При горении стартёра через него идёт ток десятки миллиампер, вольфрамовые спирали в торцах лампы ЛЛ разогреваются, обеспечивая высокую эмиссию электронов. В результате лампа ЛЛ зажигается, через неё идёт ток в сотни миллиампер. Напряжение на лампе ЛЛ и в стартёре падает и становится меньше напряжения гашения стартёра. Стартёр гаснет, вольфрамовые спирали в лампе ЛЛ остывают, разряд в лампе поддерживается за счёт ионизации атомов ртути инертного газа. В качестве люминофоров в таких лампах наиболее часто используют галлофосфат кальция, активированный сурьмой и марганцем, или смесь MgWO 4 и (ZnBe)2 SiO 4· Mn. Состав люминофора подбирается таким чтобы спектр люминесценции был ближе к спектру дневного света. Световая отдача люминесцентных ламп достигает 80 лм / Вт, а срок службы – свыше 10000 часов, что в несколько раз больше, чем у лампы накаливания. 8. Комбинационное рассеяния света. В 1928 году Леонид Мандельштам и Григорий Ландсберг, изучая рассеяние монохроматического света в кристаллах обнаружили, что у спектральных линий в рассеянном свете появляются линии – спутники. Спутники расположены с двух сторон на определённых по частоте расстояниях D n (Рис.72). В том же году этот эффект обнаружил в жидкостях индийский физик Чандрасекхара Раман. Явление назвали комбинационным рассеянием или, в западной литературе, эффектом Рамана. Основные закономерности эффекта следующие. а. Спутники сопровождают каждую линию первичного спектра б. Различие в частотах D n возбуждающей первичной линии n 0 и линий каждого из спутников n 1, n 2, n 3… характерно для рассеивающего вещества. Оно равно частотам собственных ИК колебаний его молекул. в. Спутники представляют собой системы линий, поглощаясь симметрично (по частоте) по обе стороны возбуждающей линии. г. Спутники в длиноволновой области спектра (“красные”) много интенсивнее, чем в коротковолновой (“фиолетовые”). д. С повышением температуры интенсивность “фиолетовых” спутников растёт. Суть явления в следующем. Если атом или молекула испытывают собственные колебания с частотой n, то при взаимодействии со световым квантом они могут отдать ему энергию hn и тем самым изменить частоту рассеянного света. Энергия кванта в этом случае увеличивается, hn 0+ hn=h (n 0+ n). Получается “фиолетовый” спутник. Если же квант сталкивается с “неподвижной” молекулой, то он может отдать ей энергию, энергия и частота рассеянного кванта уменьшается и станут равными hn 0 - hn и n 0 - n. Получается “красный” спутник. У холодных тел энергия колебания молекул невелика. Поэтому интенсивность “красных” спутников больше, чем “фиолетовых”. С нагреванием энергия колебания молекул растёт, а значит, растёт и интенсивность “фиолетовых” спутников. Как и люминесценция, комбинационное рассеяние света позволят исследовать внутреннюю структуру вещества. Это оптический аналог эффекта Комптона.
|
||
|
Последнее изменение этой страницы: 2017-01-23; просмотров: 604; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.028 с.) |

 . (9.1)
. (9.1)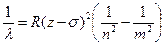 . Закон Мозли, 1914. (9.2)
. Закон Мозли, 1914. (9.2)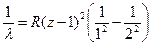 . (9.3)
. (9.3) =3,4,5. (9.4)
=3,4,5. (9.4) =4,5,... (9.5)
=4,5,... (9.5) , а по вертикальной – порядковые номера z элементов. Поражает точность выполнения закона Мозли. Точки каждой серии лежат строго на одной прямой.
, а по вертикальной – порядковые номера z элементов. Поражает точность выполнения закона Мозли. Точки каждой серии лежат строго на одной прямой. =4.
=4. движения электрона (рис.64 справа).
движения электрона (рис.64 справа). . (9.6)
. (9.6)


