
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Триады железа (железо, кобальт, никель)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Контрольные вопросы и задачи 1. Охарактеризуйте полиморфные соединения железа, кобальта. 2. Приведите пример нестехиометрического состава соединений триады железа. 3. Напишите уравнения реакций между железом и следующими веществами: а) разбавленной соляной кислотой; б) концентрированной серной кислотой; в) оксидом углерода (II); г) серой. д) Fe + SnCl2 = е) Fe + CO = 4. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: Fe Укажите условия протекания реакций. 5. Как взаимодействует Fe2O3 с растворами и с расплавами щелочей. 6. Напишите качественные реакции на катион железа (II) и катион железа (III). 7. Почему при приготовлении водных растворов солей железа (III) добавляют кислоту. 8. Как перевести соль железа (II) в соль железа (III). Как осуществить обратный переход. 9. Общие химические свойства железа, кобальта, никеля. 10. Составьте уравнения следующих реакций: FeS2 + O2 → FeO + HNO3 → Fe(OH)2 + O2 + H2O → Fe(OH)2 + 2NaOH → FeSO4 + K3[Fe(CN)6] → NiO + Ba(OH)2 → Сo(OH)2 + O2 + H2O → Fe2O3 + KNO3 + KOH → Fe(OH)3 + Na2CO3 → Fe(OH)3 + Br2 + KOH → Co(OH)3 + H2SO4 → CoCl3 + NaOH → CoCl2 + Cl2 + NaOH → Ni(OH)3 + HCl → Ni(OH)2 + Br2 + NaOH → K2FeO4 + Cr2(SO4)3 + H2SO4 → Укажите условия протекания реакций. 11. Напишите уравнения реакций между следующими веществами: а) оксидом никеля (II) и соляной кислотой; б) гидроксидом кобальта (II) и концентрированным раствором гидроксида натрия; в) гидроксидом никеля (II) и избытком раствора аммиака. 12. Какой из катионов (железа, никеля, кобальта в степени окисления +2) обладает более сильными восстановительными свойствами. Привести примеры реакций. 13. Вычислите количество железа (в кг), которое можно получить из 1 тонны пирита, содержащего 80 % FeS2. 14. К 100 г раствора хлорида кобальта (II), содержащего 10 % (масс.) CoCl2 прилили избыток раствора гидроксида натрия. Полученный осадок отфильтровали, высушили и покалили. Вычислите объем соляной кислоты (w = 24 %, плотность раствора 1,121 г/мл) необходимый для растворения полученного вещества. 15. Реакция восстановления оксида железа (II) аммиаком: 3FeO(тв.) +2NH3(г.) = 3Fe(тв.) + N2(г.) + 3H2O(г.) начинается при температуре 322oС. Вычислите DrS0298 этой реакции, если Еo(FeO(тв.)/Fe(тв.))= -0.865В и Еo(N2(г.)/NH3(г.))= - 0.771В при pH=14 и Т=298К, а DGo298(H2O(ж.)/H2O(г.))=8.63 кДж/моль. Напишите уравнения полуреакций, использованных вами при вычислении термодинамических функций. При проведении расчетов зависимостью DH0Tи DS0T реакции от температуры следует пренебречь. При какой температуре (большей или меньшей 3220С) начинается реакция восстановления FeO аммиаком? Дайте аргументированный ответ. Напишите уравнение соответствующей реакции. 16. При прокаливании 37,45 г гидроксида железа (III) получили твердый остаток. Вычислите объем соляной кислоты с массовой долей HCl 20 % (плотность раствора 1,1 г/мл), необходимый для растворения полученного вещества. 17. Вычислите объем бромной воды, необходимый для окисления 15,2 г хлорида железа (II) в кислом растворе, если в 100 г воды при температуре 200С растворяется 3,6 г брома.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 505; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.117.57 (0.01 с.) |

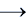 FeCl2
FeCl2 


