
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Углерод, кремний, германий, олово, свинецСодержание книги
Поиск на нашем сайте
Контрольные вопросы и задачи 1. Сопоставьте в ряду элементов главной подгруппы IV группы от углерода к кремнию изменения следующих свойств: атомных радиусов, потенциалов ионизации, сродства к электрону, электроотрицательностей, устойчивости степеней окисления. Объясните наблюдаемые закономерности. 2. Как и почему изменяется стабильность гидридов в ряду Ge – Sn – Pb. Укажите способы получения гидридов этих элементов. 3. Объясните для угольной и кремневой кислот изменения следующих параметров: термической устойчивости, кислотных свойств водных растворов. Напишите уравнения реакций, иллюстрирующих гидролиз карбонатов и силикатов щелочных элементов. В какой системе и почему гидролиз проходит более полно? 4. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: 5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: А) С
В) С Укажите условия их протекания.
6. При обработке карбида алюминия раствором соляной кислоты, масса которого 320 г и массовая доля HCl 22%, выделилось 6,72 л (н.у.) метана. Рассчитайте массовую долю соляной кислоты в полученном растворе. 7. Предложите способ синтеза силана, используя в качестве единственного источника кремния кристаллический SiO2. 8. К 300 мл.18%-ного раствора Na2CO3(ρ=1,19г/см3) добавили 500 мл 6%-ного раствора H2SO4(ρ=1,04 г/см3). Сколько мл раствора соляной кислоты с массовой долей равной 7% (ρ=1,030 г/см3) потребуется для разложения оставшейся соды? 9. Смесь углекислого газа и метана объемом 2,5 л (н.у.) пропустили через раствор гидроксида натрия. Для полного сжигания оставшегося газа потребовалось 2,24 л (н.у.) кислорода. Определите объемные доли газов в исходной смеси. 10. Какой объем занимает 1,5 моль углекислого газа при 298оК и давлении 1 бар. [1бар = 105 Па; R = 8,314 Дж/ К моль]. 11. Напишите уравнения реакций, указывающих на амфотерные свойства гидроксида олова (II), оксида свинца (II). 12. В четырех пробирках находятся сухие соли Na2CO3, NaF, Pb(NO3)2, NaI. Используя минимальное число реактивов, распознайте химическим путем, что находится в каждой пробирке. Проведите идентификацию каждого вещества на основе характерных для него реакций. Напишите уравнения всех предложенных вами реакций. 13. 1 г сухой соли Na2CO3 растворили в воде в мерной колбе на 100 мл (объем раствора довели до метки). Определите рН полученного раствора. Гидролизом по второй ступени можно пренебречь. Приведите уравнения соответствующих реакций. К2(H2CO3)=4.8*10-11. 14. Предложите схему синтеза PbO2, используя в качестве единственного источника свинца Pb(NO3)2. Запишите уравнения реакций. 15. Смесь карбоната и гидрокарбоната натрия массой 20 г растворили в избытке соляной кислоты. В результате реакции выделилось 4,48 л газа (н.у.). Определите массовые доли карбонатов в исходной смеси. 15. При действии разбавленной азотной кислоты на сурик Pb3O4 образуются темно-коричневый осадок А и раствор соли В. При добавлении к осадку А подкисленного серной кислотой водного раствора сульфата марганца (II) наблюдается окрашивание раствора в малиновый цвет в результате образования вещества С. Определите вещества А, В, С. Напишите уравнения всех упомянутых реакций. 16. Напишите уравнения реакций следующих превращений. Для ОВР реакций в растворах напишите электронно-ионные уравнения полуреакций.
Ge + HF → Ge + H2S04 (конц) → Ge + HN03 (конц) → Mg2Ge + HCl → Sn + H2S04 (конц) → Sn + HN03 (3 %).→ Sn + HNO3(3-30%) → Sn + HNO3(60%) →
Укажите условия их протекания.
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 447; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.005 с.) |

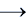 СH4
СH4 


