
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
IА и IIА группы Периодической системы
Щелочные и щелочноземельные элементы Контрольные вопросы и задачи 1. Сравните электронные конфигурации конфигурации атомов щелочных металлов. 2. Сравните электронные конфигурации атомов элементов IIА группы. 3. В чем проявляется диагональное сходство лития и магния. 4.Как изменяется в ряду Li+—Cs+ поляризующее действие катионов. Почему? 5. Как можно обнаружить щелочные металлы и их соединения. 6. Основные минералы и природные соединения щелочных и щелочноземельных элементов. 7. В трех пробирках находятся водные растворы MgCl2 , CaCl2 и BaCl2. Предложите способы идентификации содержимого каждой пробирки. Запишите уравнения реакций и укажите условия их протекания. 8. При прокаливании нитрата щелочного металла был получен твердый остаток, масса которого составила 21,7% от исходной массы нитрата. Установите состав нитрата. 9. Для растворения 1,26 г сплава магния с алюминием использовано 35 мл 19,6%-ного раствора серной кислоты (плотность1,14г /мл). Избыток кислоты вступил в реакцию с 28,6 мл раствора гидрокарбоната калия с концентрацией 1,4 моль /л. Определите массовые доли металлов в сплаве и объем газа (при н.у.), выделившегося при растворении сплава. 10. При взаимодействии 1 л 0.015 М горячего раствора гидроксида бария с 3.81 г иода образуется осадок А (ПР=1.5 10-9) и раствор В. Осадок А был отфильтрован. При прокаливании осадка А образуется белое твердое вещество, а также кислород и пары фиолетового цвета. Какой объем (н.у.) кислорода выделится при этом? 11. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Be3Al2[Si6O18] + H2SO4 → Be3Al2[Si6O18] + K2CO3 → BeO + 2HCl → BeO + 2NaOH + H2O (в растворе) → BeO + 2NaOH (в расплаве) → Be(OH)2 + HCl → Be(OH)2 + NaOH → Na + C2H5OH → Na2O + O2 → Na2O + H2 → Na2O + S → Укажите условия их протекания. 12.Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: Ca Укажите условия их протекания. 13. Для растворения смеси оксида и карбоната магния потребовалось 400 мл 2 моль/л раствора соляной кислоты. В результате взаимодействия выделилось 6,72 л газа. Определите массы веществ в смеси. 14. Вычислите объем воды, в котором необходимо растворить 2,3г металлического натрия для получения 5 %-ного раствора гидроксида натрия.
15. 16,8 г питьевой соды прокалили, и твердый остаток растворили в 100 г воды. Вычислите массовую долю соли в полученном растворе. 16. Смесь гидридов калия и натрия массой 44,8 г обработали водой. В результате химического взаимодействия выделилось 13,44 л газа водорода (н. у.). Вычислите массовые доли гидридов в исходной смеси.
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ
|
|||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 293; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.177.223 (0.004 с.) |
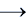 Ca(OH)2
Ca(OH)2 


