
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Подгруппа меди (медь – серебро – золото)Содержание книги
Поиск на нашем сайте Контрольные вопросы и задачи 1. В чем состоит валентная аномалия простых веществ I Б группы. 2. Уникальность физических свойств простых веществ I Б группы. 3. Что является главной причиной резко контрастирующих свойств элементов IА и I Б групп в металлическом состоянии? 4. Как, исходя из CuCl2, получить CuCl? В чем можно растворить CuCl? 5. Пирометаллургический процесс получения меди из сульфидных руд типа CuFeS2 6. Напишите уравнения реакций превращения гидроксида меди (II) в водных растворах щелочей. Отметьте его цвет. 7. Что такое реактив Швейцера. 8. Какое соединение получило название каломель. Свойства каломели. 9.Как изменяется термическая устойчивость оксидов Э2О. 10. Напишите уравнения реакций золота в царской водке. 11. Составьте уравнения следующих реакций: АgNО3 + NаОН = Ag + NaCN + O2 + H2O = Na[Ag(CN)2] + Zn = Ag2O + NH3 + H2O = AgO + H2S04 = Ag2О3 + НСl = Укажите условия их протекания. 12. Составьте уравнения реакций между серебром и следующими веществами: а) концентрированным раствором азотной кислоты; б) концентрированным раствором серной кислоты; в) цианидом калия в присутствии кислорода; г) серой; между следующими веществами: а) бромидом серебра и тиосульфатом натрия; б) йодидом серебра и йодидом калия; в) ацетатом серебра и медью. Укажите условия протекания реакций. 13. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: Ag Ag Укажите условия их протекания.→ 14. Почему поверхность серебра чернеет на воздухе. 15. Вычислить, сколько цианида натрия потребуется для извлечения самородного золота из 10 т золотоносной породы, содержащей 0,01% Au по массе. Реакция протекает по схеме: Au + O2 + NaCN + H2 O = Na[Au(CN)2] + NaOH 16. Составьте уравнения следующих реакций: 17. Сплав меди и серебра массой 10 г обработали разбавленным раствором азотной кислоты. После прекращения реакции к полученному раствору прилили избыток раствора хлорида калия. Полученный осадок отфильтровали, выпарили и взвесили. Масса осадка равна 7,175 г. Рассчитайте массовые доли металлов в сплаве. 18. Сплав Zn и Ag массой 116, 8 г обработали концентрированной азотной кислотой. После прекращения реакции к полученному раствору прилили избыток раствора KCl. Полученный осадок отфильтровали, выпарили и взвесили. Масса осадка равна 86,1 г. Рассчитайте массы металлов в сплаве. 19. Вычислите значение концентрации катионов серебра (I) в растворе трицианоаргентата (I) калия концентрацией 0,001 моль/ л. Кн [Ag(CN)3]2- =1,0 · 10-22 20. Можно ли разрушить комплексный ион [Ag(NH3)2]+ (С = 0,1 моль/ л) добавлением раствора хлорида калия равного объема и равной концентрации?
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 433; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

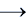 Ag2SO4
Ag2SO4 


