Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рациональная терапия железодефицитных анемий у детей препаратами железа для применения внутрьСодержание книги
Поиск на нашем сайте
Авторы: А.Е. Абатуров, И.Л. Высочина, О.Н. Герасименко, Днепропетровская государственная медицинская академия Введение Железодефицитная анемия (ЖДА) — широко распространенное патологическое состояние, лечение и профилактика которого, несмотря на достижения современной медицины, представляют глобальную проблему [3, 25]. Согласно данным ВОЗ, дефицит железа среди народонаселения земного шара достигает 60–80 %, а ЖДА страдают около 2 миллиардов человек [24, 26]. В США до 700 000 детей первых двух лет жизни имеют дефицит железа, который у 240 000 детей сопровождается развитием анемии [21]. Согласно официальным статистическим данным, в Украине железодефицитной анемией страдает 20–30 % женщин детородного возраста и 2–3 % детей [2, 8]. По данным И.Б. Ершовой и соавт. [4], среди детей раннего возраста, проживающих в селитебной зоне, ЖДА встречается в 21–30 % случаев. Дефицит железа и железодефицитная анемия Железодефицитная анемия — это клинико-гематологический синдром, в основе которого лежит недостаточность обеспечения потребностей эритропоэза железом и клинически проявляется общеанемическим синдромом и признаками сидеропении. Клинико-гематологическому проявлению ЖДА длительное время предшествует постепенное развитие латентного дефицита железа. Стадии дефицита железа 1. Стадия латентного дефицита железа, которая характеризуется снижением уровня запаса железа костного мозга при нормальном насыщении трансферрина железом. 2. Ранняя стадия железодефицитной анемии, которая характеризуется нормоцитарной, нормохромной анемией, снижением содержания железа депо и насыщения трансферрина железом (менее 20 %). 3. Стадия явной железодефицитной анемии, характерными признаками которой являются гипохромная, микроцитарная анемия, отсутствие железа депо и резкое снижение насыщения трансферрина железом (менее 10 %). 4. Стадия тканевого дефицита железа: гипохромная, микроцитарная анемия, отсутствие железа депо, насыщение трансферрина менее 10 %, признаки гипосидерогистии (койлонихии, глоссит, дисфагия и другие проявления поражения органов и систем организма) [18, 23]. Критерии диагностики латентного дефицита железа [8] 1. Содержание гемоглобина (Hb) у детей в возрасте до шести лет не ниже 110 г/л и у детей старше 6 лет не ниже 120 г/л. 2. Гематокрит у детей в возрасте до шести лет не ниже 35 % и у детей старше 6 лет не ниже 37%. 3. Уровень концентрации сывороточного железа (СЖ) ниже 14 мкмоль/л. 4. Общая железосвязывающая способность сыворотки (ОЖСС) выше 63 мкмоль/л. 5. Насыщение трансферрина железом (НТЖ) в пределах 16–20 %. НТЖ вычисляется по формуле: Fe сыворотки (мкмоль/л) / ОЖСС х 100 %. 6. Уровень концентрации сывороточного ферритина (СФ) ниже 20 мг/мл. 7. Степень анизоцитоза эритроцитов (RDW) более 14,5 %. 8. Средний объем эритроцитов (MCV) ниже 80 фл. 9. Среднее содержание гемоглобина в эритроците (MCH) в пределах 27–35 нг. 10. Средняя концентрация гемоглобина в эритроците (MCHC) в пределах 32–38 г/л. Критерии диагностики железодефицитной анемии Согласно рекомендациям ВОЗ, анемия у детей первого месяца жизни диагностируется при уровне концентрации Hb в венозной крови ниже 115 г/л, у детей до шестилетнего возраста — ниже 110 г/л, у детей старше 6 лет — ниже 120 г/л [26]. Необходимо учитывать, что в венозной крови уровень Hb ниже, чем в капиллярной крови на 10–20 %. Критерии анемии у новорожденных детей зависят от гестационного возраста (табл. 1).
Сочетание нормо- или гипохромной анемии и документированного дефицита железа позволяет поставить диагноз ЖДА. Степень снижения концентрации Hb определяет тяжесть ЖДА. Уровень концентрации Hb 110–91 г/л соответствует легкой тяжести, 90–71 г/л — средней тяжести, 70–51 г/л — тяжелой степени тяжести ЖДА [5, 7, 8]. Лечение ЖДА препаратами железа Принципы лечения ЖДА В основе лечения ЖДА лежат следующие принципы. 1. Обязательное назначение препаратов железа (невозможно возместить дефицит железа исключительно диетотерапией). 2. Исключение одновременного приема препаратов железа и продуктов питания, лекарственных средств, уменьшающих всасывание железа. 3. Препаратами выбора являются железосодержащие средства для орального применения. Предпочтение следует отдавать препаратам, которые содержат вещества, усиливающие абсорбцию железа (в частности, аскорбиновую кислоту). 4. Нецелесообразность одновременного назначения с препаратами железа витамина В12, фолиевой кислоты без специальных показаний. 5. Соблюдение адекватности дозы железа и продолжительности терапии степени железодефицита. 6. Обязательный контроль эффективности терапии препаратами железа: исследование содержания ретикулоцитов в периферическом русле крови на 10–12-й день от начала лечения и определение концентрации ферритина в сыворотке крови один раз в два месяца [2, 3, 5, 7, 11]. Противопоказания для назначения препаратов железа внутрь Непереносимость препаратов железа; заболевания, характеризующиеся синдромом мальабсорбции; гемосидероз; гемохроматоз; гемолитические, гипопластические, мегалобластные анемии; талассемия; язвенная болезнь желудка; болезнь Крона; неспецифический язвенный колит. Препараты железа для приема внутрь В настоящее время на украинском фармацевтическом рынке железосодержащие лекарственные средства представлены двумя группами препаратов, действующими веществами которых являются ионные соединения (солевые, полисахаридные соединения железа) и неионные соединения железа, различающиеся по механизмам абсорбции. Всасывание железа из ионных соединений зависит от валентности ионов железа. Железо абсорбируется зрелыми энтероцитами в основном в виде ферро-ионов (Fe2+). Трехвалентное железо (ферри-ионы) частично импортируются в энтероцит, но большая часть восстанавливается до ферро-ионов. Ферри-ионы (Fe3+), взаимодействуя с муцином и β3-интегрином, импортируются во внутриклеточное пространство энтероцита ворсинок слизистой оболочки двенадцатиперстной кишки при помощи внеклеточно расположенного шаперона — кальретикулинподобного мобилферрина [19, 22]. Определенная часть ионов Fe3+ на апикальной поверхности ворсинчатого эпителия под воздействием мембраносвязанной ферриредуктазы щеточной каймы энтероцита (дуоденального цитохрома b — Dcyt b) восстанавливается до двухвалентного состояния (ферро-ионов — Fe2+) [20]. Процесс восстановления железа зависит от многих факторов, в частности от характера пищи, кислотности желудочного сока. Поэтому препараты двухвалентного железа обладают более высокой степенью биодоступности [1, 7, 9]. Транспорт ферро-ионов из дуоденального содержимого в цитоплазму зрелых энтероцитов осуществляется при помощи двухвалентного транспортера металлов 1 [20]. Препараты железа неионных соединений представлены гидроксид-полимальтозным комплексом, который состоит из многоядерных центров гидроксида Fe3+, нековалентно связанных с молекулами полимальтозы. Неионная форма комплекса обеспечивает стабильность его структуры, постепенное освобождение от ферри-ионов, которые импортируются белком-транспортером в цитоплазму зрелого энтероцита ворсинки слизистой оболочки двенадцатиперстной и проксимальных отделов тощей кишки [6, 10-12, 22]. В настоящее время на фармацевтическом рынке представлен широкий ассортимент как монокомпонентных, так и комбинированных препаратов железа (табл. 2). При восполнении дефицита железа у детей используются железосодержащие лекарственные средства, обладающие достаточной биодоступностью и безопасностью, терапевтической эффективностью и характеризующиеся хорошими органолептическими качествами [8, 10].
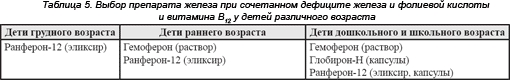
Выбор препарата железа при лечении ЖДА При выборе препарата железа необходимо учитывать возраст пациента, наличие дефицита фолиевой кислоты, цианокобаламина, форму выпуска препарата, содержание элементарного железа и наличие других лекарственных компонентов в препарате (табл. 3-5).
По степени абсорбции и профилю безопасности из лекарственных средств двухвалентного железа наиболее оптимальными являются препараты, содержащие глюконат железа [9]. В основе безопасности применения глюконата железа лежит низкое содержание элементарного железа (12% Fe2+), в связи с чем он, несомненно, может быть рекомендован как лекарственное средство выбора для лечения и профилактики ЖДА у детей. Особенное значение при восполнении дефицита железа у детей имеют препараты, содержащие глюконат железа в сочетании с аскорбиновой кислотой, так как аскорбиновая кислота усиливает абсорбцию железа в кишечнике и использование железа эритроном [17]. Предполагают, что витамин С препятствует действию гепцидина на ферропортин-1, тем самым увеличивая экспорт железа из зрелых энтероцитов ворсинок слизистой оболочки двенадцатиперстной кишки, макрофагов и гепатоцитов [16]. При выборе лекарственных средств, содержащих трехвалентное железо, предпочтение отдается препаратам неионных соединений железа [6, 11, 14]. Рекомендуемые дозы железа при лечении детей с ЖДА Стартовое лечение ЖДА начинают с суточной дозы, которая для детей раннего возраста составляет 1–1,5 мг/кг/сутки элементарного железа, для детей старшего возраста — 1/2–1/3 средней терапевтической дозы. В последующем суточную дозу постепенно (в течение 7–14 дней) увеличивают, достигая дозы насыщения. Препараты железа в дозе насыщения назначают в течение первого месяца терапии, затем переходят на поддерживающую суточную дозу (табл. 6). Детям с латентным дефицитом железа назначают половину терапевтической дозы (при назначении солевых препаратов железа профилактическая доза составляет 1,5 мг/кг массы, а при назначении полимальтозного комплекса гидрооксида железа — 2,5 мг/кг массы в сутки). Препараты железа принимают внутрь за 1 час до еды 301504 раза в сутки [6, 7].
Терапия считается эффективной при наличии ретикулоцитарной реакции на 10–12-й день, повышении уровня гемоглобина на 3–4-й неделе, исчезновении клинических проявлений анемии через 1–2 месяца, исчезновении признаков тканевой сидеропении через 3–5 месяцев от начала применения препаратов железа. Основным критерием достаточности ферротерапии при ЖДА является восстановление уровня сывороточного ферритина [6, 12, 13]. Профилактика Антенатальная профилактика Всем здоровым беременным женщинам для профилактики дефицита железа плода рекомендуется назначение препаратов железа для применения внутрь — при первой беременности со второй половины беременности, при повторной беременности начиная со второго триместра. Постнатальная профилактика Естественной профилактикой ЖДА у детей первых месяцев жизни является исключительно грудное вскармливание. При искусственном вскармливании у детей группы риска по развитию железодефицитной анемии (недоношенные, маловесные дети, двойни, тройни) следует использовать молочные смеси, обогащенные железом (НАН с железом, Нутрилон 1, Симилак, Фрисолак, Хипп 1). В системе профилактики железодефицитной анемии у детей первого года жизни существенное значение имеет своевременное введение продуктов прикорма, обогащенных железом (фруктовых соков, фруктовых и овощных пюре, мясных блюд) [6]. Препараты железа для применения внутрь назначают с 4–6 месяцев жизни. Профилактическая доза железа составляет 1 мг FeFe2+/кг в сутки [7, 13]. Таким образом, для организации лечения железодефицитных состояний необходима диагностика латентных форм железодефицита. Терапия ЖДА у детей требует дифференцированного выбора препаратов железа. У детей с изолированным проявлением железодефицита рекомендуются солютабные препараты, содержащие глюконат железа и аскорбиновую кислоту, или препараты, лекарственным компонентом которых является полимальтозный комплекс гидрооксида железа. Эффективность и достаточность терапии препаратами железа оценивают по уровню концентрации ферритина в сыворотке крови. По окончании курса терапии рекомендуется прием препаратов железа в профилактической дозе.
Список литературы / References 1. Гайдукова С.М., Видиборець С.В., Колесник І.В. Залізодефіцитна анемія. — К.: Наук. світ, 2001. — 132 с. 2. Гайдукова С., Выдыборец С. Железодефицитная анемия // Ліки України. — 2004. — № 9. — С. 25-29. 3. Дворецкий Л.И. Железодефицитные анемии. — М.: Ньюдиамед, 1998. — 37 с. 4. Єршова І.Б., Манолова Е.П., Бордюгова О.В. Захворюваність на залізодефіцитну анемію, її лікування та профілактика у дітей першого року життя // ПАГ. — 2002. — № 4. — С. 34. 5. Идельсон Л.И. Гипохромные анемии. — М.: Медицина, 1981. — 192 с. 6. Коровина Н.А., Захарова И.Н., Заплатников А.Л., Малова Н.Е. Профилактика и лечение железодефицитных состояний у детей // Леч. врач. — 2004. — № 1. — С. 24-28. 7. Коровина Н.А., Заплатников А.Л., Захарова И.Н. Железодефицитные анемии у детей (Руководство для врачей). — М., 1999. — 56 с. 8. Майданник В.Г. Современные подходы к диагностике и лечению железодефицитных состояний // Доктор. — 2002. — № 3. — С. 86-88. 9. Наконечная О.А. Общая характеристика соединений железа, их всасывание и применение при ЖДА // Новости медицины и фармации. — 2006. — № 5. — С. 8. 10. Новые возможности ферротерапии железодефицитной анемии / Казюкова Т.В., Самсыгина Г.А., Калашникова Г.В., Румянцев А.Г., Фаллух А., Мотина А.Г., Левина А.А. // Клин. фарм. тер. — 2000. — Т. 9, № 2. — С. 88-91. 11. Самсыгина Г.А. Железодефицитные анемии у детей, фармакология и фармакокинетика современных ферропрепаратов // Дефицит железа и железодефицитная анемия у детей. — М.: Славянский диалог. — 2001. — С. 108-113. 12. Соболева М.К. Эффективность ферропрепаратов и их побочные действия при лечении железодефицитной анемии у детей // Педиатрия. — 2004. — № 1. — С. 79-84. 13. Цимбал И.Н. Железодефицитая анемия у детей // Леч. врач. — 2001. — № 10. — С. 22-27. 14. Ципкун А.Г., Омельченко Л.И. Эффективность и переносимость препарата Ферумбо у детей // Здоровье ребенка. — 2006. — № 1. — С. 60-63. 15. Шабалов Н.П. Неонатология. — СПб., 2004 — С. 171-187. 16. Deicher R., Hörl W.H. Hepcidin: a molecular link between inflammation and anaemia // Nephrol. Dial. Transplant. — 2004. — Vol. 19, № 3. — P. 521-524. 17. Deicher R., Hörl W.H. Vitamin C in chronic kidney disease and hemodialysis patients // Kidney Blood. Press. Res. — 2003. — Vol. 26. — P. 100-106. 18. Leung A.K., Chan K.W. Iron deficiency anaemia // Adv. Pediatr. — 2001. — V. 48. — P. 385-408. 19. Localization of the iron transport proteins Mobilferrin and DMT-1 in the duodenum: the surprising role of mucin / Simovich M., Hainsworth L.N., Fields P.A., Umbreit J.N., Conrad M.E. // Am. J. Hematol. — 2003. — Vol. 74, № 1. — P. 32-45. 20. Ma Y., Yeh M., Yeh K.Y., Glass J. Iron Imports. V. Transport of iron through the intestinal epithelium // Am. J. Physiol. Gastrointest. Liver Physiol. — 2006. — Vol. 290, № 3. — P. G417-422. 21. Prevalence of iron deficiency in the United States / Looker A.C., Dallman P.R., Carroll M.D., Gunter E.W., Johnson C.L // JAMA. — 1997. — Vol. 27. — P. 973-976. 22. Roy C.N., Enns C.A. Iron homeostasis: new tales from the crypt // Blood. — 2000. — Vol. 96. — P. 4020-4027. 23. Shah A. Iron deficiency anemia-Part-I // Indian. J. Med. Sci. — 2004. — Vol. 58, № 2. — P. 79-81. 24. UNICEF/UNU/WHO/MI. Preventing iron deficiency in women and children: technical consensus on key issues // Technical Workshop. — New York: UNICEF/UNU/WHO/MI, 1998. 25. United Nations Administrative Committee on Coordination Sub-Committee on Nutrition (ACC/SCN) // Fourth report on the world nutrition situation. — Geneva: ACC/SCN in collaboration with International Food Policy Research Institute, 2000. 26. World Health Organization. Iron deficiency anemia: Assessment, prevention and control. — Geneva: WHO, 2001. — 114 p.
|
||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 335; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.37.200 (0.008 с.) |