Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Журнал «Здоровье ребенка» 3(3) 2006Содержание книги
Поиск на нашем сайте
Журнал «Здоровье ребенка» 3(3) 2006 Рациональная терапия железодефицитных анемий у детей препаратами железа для применения внутрь Авторы: А.Е. Абатуров, И.Л. Высочина, О.Н. Герасименко, Днепропетровская государственная медицинская академия Введение Железодефицитная анемия (ЖДА) — широко распространенное патологическое состояние, лечение и профилактика которого, несмотря на достижения современной медицины, представляют глобальную проблему [3, 25]. Согласно данным ВОЗ, дефицит железа среди народонаселения земного шара достигает 60–80 %, а ЖДА страдают около 2 миллиардов человек [24, 26]. В США до 700 000 детей первых двух лет жизни имеют дефицит железа, который у 240 000 детей сопровождается развитием анемии [21]. Согласно официальным статистическим данным, в Украине железодефицитной анемией страдает 20–30 % женщин детородного возраста и 2–3 % детей [2, 8]. По данным И.Б. Ершовой и соавт. [4], среди детей раннего возраста, проживающих в селитебной зоне, ЖДА встречается в 21–30 % случаев. Дефицит железа и железодефицитная анемия Железодефицитная анемия — это клинико-гематологический синдром, в основе которого лежит недостаточность обеспечения потребностей эритропоэза железом и клинически проявляется общеанемическим синдромом и признаками сидеропении. Клинико-гематологическому проявлению ЖДА длительное время предшествует постепенное развитие латентного дефицита железа. Стадии дефицита железа 1. Стадия латентного дефицита железа, которая характеризуется снижением уровня запаса железа костного мозга при нормальном насыщении трансферрина железом. 2. Ранняя стадия железодефицитной анемии, которая характеризуется нормоцитарной, нормохромной анемией, снижением содержания железа депо и насыщения трансферрина железом (менее 20 %). 3. Стадия явной железодефицитной анемии, характерными признаками которой являются гипохромная, микроцитарная анемия, отсутствие железа депо и резкое снижение насыщения трансферрина железом (менее 10 %). 4. Стадия тканевого дефицита железа: гипохромная, микроцитарная анемия, отсутствие железа депо, насыщение трансферрина менее 10 %, признаки гипосидерогистии (койлонихии, глоссит, дисфагия и другие проявления поражения органов и систем организма) [18, 23]. Критерии диагностики латентного дефицита железа [8] 1. Содержание гемоглобина (Hb) у детей в возрасте до шести лет не ниже 110 г/л и у детей старше 6 лет не ниже 120 г/л. 2. Гематокрит у детей в возрасте до шести лет не ниже 35 % и у детей старше 6 лет не ниже 37%. 3. Уровень концентрации сывороточного железа (СЖ) ниже 14 мкмоль/л. 4. Общая железосвязывающая способность сыворотки (ОЖСС) выше 63 мкмоль/л. 5. Насыщение трансферрина железом (НТЖ) в пределах 16–20 %. НТЖ вычисляется по формуле: Fe сыворотки (мкмоль/л) / ОЖСС х 100 %. 6. Уровень концентрации сывороточного ферритина (СФ) ниже 20 мг/мл. 7. Степень анизоцитоза эритроцитов (RDW) более 14,5 %. 8. Средний объем эритроцитов (MCV) ниже 80 фл. 9. Среднее содержание гемоглобина в эритроците (MCH) в пределах 27–35 нг. 10. Средняя концентрация гемоглобина в эритроците (MCHC) в пределах 32–38 г/л. Критерии диагностики железодефицитной анемии Согласно рекомендациям ВОЗ, анемия у детей первого месяца жизни диагностируется при уровне концентрации Hb в венозной крови ниже 115 г/л, у детей до шестилетнего возраста — ниже 110 г/л, у детей старше 6 лет — ниже 120 г/л [26]. Необходимо учитывать, что в венозной крови уровень Hb ниже, чем в капиллярной крови на 10–20 %. Критерии анемии у новорожденных детей зависят от гестационного возраста (табл. 1).
Сочетание нормо- или гипохромной анемии и документированного дефицита железа позволяет поставить диагноз ЖДА. Степень снижения концентрации Hb определяет тяжесть ЖДА. Уровень концентрации Hb 110–91 г/л соответствует легкой тяжести, 90–71 г/л — средней тяжести, 70–51 г/л — тяжелой степени тяжести ЖДА [5, 7, 8]. Лечение ЖДА препаратами железа Принципы лечения ЖДА В основе лечения ЖДА лежат следующие принципы. 1. Обязательное назначение препаратов железа (невозможно возместить дефицит железа исключительно диетотерапией). 2. Исключение одновременного приема препаратов железа и продуктов питания, лекарственных средств, уменьшающих всасывание железа. 3. Препаратами выбора являются железосодержащие средства для орального применения. Предпочтение следует отдавать препаратам, которые содержат вещества, усиливающие абсорбцию железа (в частности, аскорбиновую кислоту). 4. Нецелесообразность одновременного назначения с препаратами железа витамина В12, фолиевой кислоты без специальных показаний. 5. Соблюдение адекватности дозы железа и продолжительности терапии степени железодефицита. 6. Обязательный контроль эффективности терапии препаратами железа: исследование содержания ретикулоцитов в периферическом русле крови на 10–12-й день от начала лечения и определение концентрации ферритина в сыворотке крови один раз в два месяца [2, 3, 5, 7, 11]. Противопоказания для назначения препаратов железа внутрь Непереносимость препаратов железа; заболевания, характеризующиеся синдромом мальабсорбции; гемосидероз; гемохроматоз; гемолитические, гипопластические, мегалобластные анемии; талассемия; язвенная болезнь желудка; болезнь Крона; неспецифический язвенный колит. Препараты железа для приема внутрь В настоящее время на украинском фармацевтическом рынке железосодержащие лекарственные средства представлены двумя группами препаратов, действующими веществами которых являются ионные соединения (солевые, полисахаридные соединения железа) и неионные соединения железа, различающиеся по механизмам абсорбции. Всасывание железа из ионных соединений зависит от валентности ионов железа. Железо абсорбируется зрелыми энтероцитами в основном в виде ферро-ионов (Fe2+). Трехвалентное железо (ферри-ионы) частично импортируются в энтероцит, но большая часть восстанавливается до ферро-ионов. Ферри-ионы (Fe3+), взаимодействуя с муцином и β3-интегрином, импортируются во внутриклеточное пространство энтероцита ворсинок слизистой оболочки двенадцатиперстной кишки при помощи внеклеточно расположенного шаперона — кальретикулинподобного мобилферрина [19, 22]. Определенная часть ионов Fe3+ на апикальной поверхности ворсинчатого эпителия под воздействием мембраносвязанной ферриредуктазы щеточной каймы энтероцита (дуоденального цитохрома b — Dcyt b) восстанавливается до двухвалентного состояния (ферро-ионов — Fe2+) [20]. Процесс восстановления железа зависит от многих факторов, в частности от характера пищи, кислотности желудочного сока. Поэтому препараты двухвалентного железа обладают более высокой степенью биодоступности [1, 7, 9]. Транспорт ферро-ионов из дуоденального содержимого в цитоплазму зрелых энтероцитов осуществляется при помощи двухвалентного транспортера металлов 1 [20]. Препараты железа неионных соединений представлены гидроксид-полимальтозным комплексом, который состоит из многоядерных центров гидроксида Fe3+, нековалентно связанных с молекулами полимальтозы. Неионная форма комплекса обеспечивает стабильность его структуры, постепенное освобождение от ферри-ионов, которые импортируются белком-транспортером в цитоплазму зрелого энтероцита ворсинки слизистой оболочки двенадцатиперстной и проксимальных отделов тощей кишки [6, 10-12, 22]. В настоящее время на фармацевтическом рынке представлен широкий ассортимент как монокомпонентных, так и комбинированных препаратов железа (табл. 2). При восполнении дефицита железа у детей используются железосодержащие лекарственные средства, обладающие достаточной биодоступностью и безопасностью, терапевтической эффективностью и характеризующиеся хорошими органолептическими качествами [8, 10].
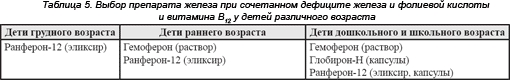
Выбор препарата железа при лечении ЖДА При выборе препарата железа необходимо учитывать возраст пациента, наличие дефицита фолиевой кислоты, цианокобаламина, форму выпуска препарата, содержание элементарного железа и наличие других лекарственных компонентов в препарате (табл. 3-5).
По степени абсорбции и профилю безопасности из лекарственных средств двухвалентного железа наиболее оптимальными являются препараты, содержащие глюконат железа [9]. В основе безопасности применения глюконата железа лежит низкое содержание элементарного железа (12% Fe2+), в связи с чем он, несомненно, может быть рекомендован как лекарственное средство выбора для лечения и профилактики ЖДА у детей. Особенное значение при восполнении дефицита железа у детей имеют препараты, содержащие глюконат железа в сочетании с аскорбиновой кислотой, так как аскорбиновая кислота усиливает абсорбцию железа в кишечнике и использование железа эритроном [17]. Предполагают, что витамин С препятствует действию гепцидина на ферропортин-1, тем самым увеличивая экспорт железа из зрелых энтероцитов ворсинок слизистой оболочки двенадцатиперстной кишки, макрофагов и гепатоцитов [16]. При выборе лекарственных средств, содержащих трехвалентное железо, предпочтение отдается препаратам неионных соединений железа [6, 11, 14]. Рекомендуемые дозы железа при лечении детей с ЖДА Стартовое лечение ЖДА начинают с суточной дозы, которая для детей раннего возраста составляет 1–1,5 мг/кг/сутки элементарного железа, для детей старшего возраста — 1/2–1/3 средней терапевтической дозы. В последующем суточную дозу постепенно (в течение 7–14 дней) увеличивают, достигая дозы насыщения. Препараты железа в дозе насыщения назначают в течение первого месяца терапии, затем переходят на поддерживающую суточную дозу (табл. 6). Детям с латентным дефицитом железа назначают половину терапевтической дозы (при назначении солевых препаратов железа профилактическая доза составляет 1,5 мг/кг массы, а при назначении полимальтозного комплекса гидрооксида железа — 2,5 мг/кг массы в сутки). Препараты железа принимают внутрь за 1 час до еды 301504 раза в сутки [6, 7].
Терапия считается эффективной при наличии ретикулоцитарной реакции на 10–12-й день, повышении уровня гемоглобина на 3–4-й неделе, исчезновении клинических проявлений анемии через 1–2 месяца, исчезновении признаков тканевой сидеропении через 3–5 месяцев от начала применения препаратов железа. Основным критерием достаточности ферротерапии при ЖДА является восстановление уровня сывороточного ферритина [6, 12, 13]. Профилактика Антенатальная профилактика Всем здоровым беременным женщинам для профилактики дефицита железа плода рекомендуется назначение препаратов железа для применения внутрь — при первой беременности со второй половины беременности, при повторной беременности начиная со второго триместра. Постнатальная профилактика Естественной профилактикой ЖДА у детей первых месяцев жизни является исключительно грудное вскармливание. При искусственном вскармливании у детей группы риска по развитию железодефицитной анемии (недоношенные, маловесные дети, двойни, тройни) следует использовать молочные смеси, обогащенные железом (НАН с железом, Нутрилон 1, Симилак, Фрисолак, Хипп 1). В системе профилактики железодефицитной анемии у детей первого года жизни существенное значение имеет своевременное введение продуктов прикорма, обогащенных железом (фруктовых соков, фруктовых и овощных пюре, мясных блюд) [6]. Препараты железа для применения внутрь назначают с 4–6 месяцев жизни. Профилактическая доза железа составляет 1 мг FeFe2+/кг в сутки [7, 13]. Таким образом, для организации лечения железодефицитных состояний необходима диагностика латентных форм железодефицита. Терапия ЖДА у детей требует дифференцированного выбора препаратов железа. У детей с изолированным проявлением железодефицита рекомендуются солютабные препараты, содержащие глюконат железа и аскорбиновую кислоту, или препараты, лекарственным компонентом которых является полимальтозный комплекс гидрооксида железа. Эффективность и достаточность терапии препаратами железа оценивают по уровню концентрации ферритина в сыворотке крови. По окончании курса терапии рекомендуется прием препаратов железа в профилактической дозе.
Список литературы / References 1. Гайдукова С.М., Видиборець С.В., Колесник І.В. Залізодефіцитна анемія. — К.: Наук. світ, 2001. — 132 с. 2. Гайдукова С., Выдыборец С. Железодефицитная анемия // Ліки України. — 2004. — № 9. — С. 25-29. 3. Дворецкий Л.И. Железодефицитные анемии. — М.: Ньюдиамед, 1998. — 37 с. 4. Єршова І.Б., Манолова Е.П., Бордюгова О.В. Захворюваність на залізодефіцитну анемію, її лікування та профілактика у дітей першого року життя // ПАГ. — 2002. — № 4. — С. 34. 5. Идельсон Л.И. Гипохромные анемии. — М.: Медицина, 1981. — 192 с. 6. Коровина Н.А., Захарова И.Н., Заплатников А.Л., Малова Н.Е. Профилактика и лечение железодефицитных состояний у детей // Леч. врач. — 2004. — № 1. — С. 24-28. 7. Коровина Н.А., Заплатников А.Л., Захарова И.Н. Железодефицитные анемии у детей (Руководство для врачей). — М., 1999. — 56 с. 8. Майданник В.Г. Современные подходы к диагностике и лечению железодефицитных состояний // Доктор. — 2002. — № 3. — С. 86-88. 9. Наконечная О.А. Общая характеристика соединений железа, их всасывание и применение при ЖДА // Новости медицины и фармации. — 2006. — № 5. — С. 8. 10. Новые возможности ферротерапии железодефицитной анемии / Казюкова Т.В., Самсыгина Г.А., Калашникова Г.В., Румянцев А.Г., Фаллух А., Мотина А.Г., Левина А.А. // Клин. фарм. тер. — 2000. — Т. 9, № 2. — С. 88-91. 11. Самсыгина Г.А. Железодефицитные анемии у детей, фармакология и фармакокинетика современных ферропрепаратов // Дефицит железа и железодефицитная анемия у детей. — М.: Славянский диалог. — 2001. — С. 108-113. 12. Соболева М.К. Эффективность ферропрепаратов и их побочные действия при лечении железодефицитной анемии у детей // Педиатрия. — 2004. — № 1. — С. 79-84. 13. Цимбал И.Н. Железодефицитая анемия у детей // Леч. врач. — 2001. — № 10. — С. 22-27. 14. Ципкун А.Г., Омельченко Л.И. Эффективность и переносимость препарата Ферумбо у детей // Здоровье ребенка. — 2006. — № 1. — С. 60-63. 15. Шабалов Н.П. Неонатология. — СПб., 2004 — С. 171-187. 16. Deicher R., Hörl W.H. Hepcidin: a molecular link between inflammation and anaemia // Nephrol. Dial. Transplant. — 2004. — Vol. 19, № 3. — P. 521-524. 17. Deicher R., Hörl W.H. Vitamin C in chronic kidney disease and hemodialysis patients // Kidney Blood. Press. Res. — 2003. — Vol. 26. — P. 100-106. 18. Leung A.K., Chan K.W. Iron deficiency anaemia // Adv. Pediatr. — 2001. — V. 48. — P. 385-408. 19. Localization of the iron transport proteins Mobilferrin and DMT-1 in the duodenum: the surprising role of mucin / Simovich M., Hainsworth L.N., Fields P.A., Umbreit J.N., Conrad M.E. // Am. J. Hematol. — 2003. — Vol. 74, № 1. — P. 32-45. 20. Ma Y., Yeh M., Yeh K.Y., Glass J. Iron Imports. V. Transport of iron through the intestinal epithelium // Am. J. Physiol. Gastrointest. Liver Physiol. — 2006. — Vol. 290, № 3. — P. G417-422. 21. Prevalence of iron deficiency in the United States / Looker A.C., Dallman P.R., Carroll M.D., Gunter E.W., Johnson C.L // JAMA. — 1997. — Vol. 27. — P. 973-976. 22. Roy C.N., Enns C.A. Iron homeostasis: new tales from the crypt // Blood. — 2000. — Vol. 96. — P. 4020-4027. 23. Shah A. Iron deficiency anemia-Part-I // Indian. J. Med. Sci. — 2004. — Vol. 58, № 2. — P. 79-81. 24. UNICEF/UNU/WHO/MI. Preventing iron deficiency in women and children: technical consensus on key issues // Technical Workshop. — New York: UNICEF/UNU/WHO/MI, 1998. 25. United Nations Administrative Committee on Coordination Sub-Committee on Nutrition (ACC/SCN) // Fourth report on the world nutrition situation. — Geneva: ACC/SCN in collaboration with International Food Policy Research Institute, 2000. 26. World Health Organization. Iron deficiency anemia: Assessment, prevention and control. — Geneva: WHO, 2001. — 114 p.
Введение Термин «пробиотик» впервые был предложен Daniel M. Lilly и R.H. Stillwell в 1965 году для обозначения лекарственных средств, содержащих культуру микрофлоры человека, которая стимулирует рост комменсальных бактерий кишечника [22]. В рекомендациях ВОЗ (2001) данное понятие получило следующее определение: пробиотик — это живые микроорганизмы или продукты их жизнедеятельности, которые при применении в адекватных количествах полезны для здоровья хозяина [30]. Согласно требованиям Продовольственной и сельскохозяйственной организации при ООН (Food and Agriculture organization of the United Nations — FAO) и ВОЗ (2002), микроорганизмы, входящие в состав пробиотика, должны быть непатогенными и нетоксичными; иметь генетический паспорт и доказательство генетической стабильности (быть чувствительными или иметь природную резистентность к антибиотикам), могли бы выживать в кишечнике; сохранять стабильность состава и жизнедеятельность в течение всего срока хранения; должны состоять из клеток, которые обладают высокой адгезивной и антагонистической способностью к патогенным, условно-патогенным микроорганизмам и не ингибируют нормальную микрофлору кишечника [3–6, 8, 9]. Пробиотические бактерии В настоящее время на основании результатов многочисленных рандомизированных плацебо-контролируемых сравнительных исследований определена эффективность различных пробиотических средств (табл. 1) при разных клинических ситуациях как у детей, так и у взрослых пациентов [1, 2].
Введение На протяжении многих лет в структуре инфекционной патологии детей второе место после острых респираторных заболеваний прочно занимают острые кишечные инфекции, этиологическими лидерами которых являются тропные к пищеварительному тракту вирусы, и в первую очередь ротавирусы. Удельный вес ротавирусных инфекций, которые, как правило, сопровождаются обезвоживанием организма больного, составляет 60–75 % всех случаев инфекционных диарей у детей. В Украине показатели заболеваемости ротавирусной инфекцией в отдельные годы колебались от 0,94 до 3,18 на 100 тысяч населения. Заболеваемость ротавирусной инфекцией среди детей значительно превышает таковую у взрослого населения [2, 3, 15]. Ведущим синдромом острой кишечной инфекции, который определяет течение и исход болезни, является диарея, выраженность которой определяет развитие эксикоза [5]. Основным направлением патогенетического лечения инфекционных диарей, которые сопровождаются возникновением обезвоживания, является регидратационная терапия. Считается, что при лечении большинства пациентов с инфекционной диареей, протекающей с обезвоживанием, восполнение патологической потери жидкости может быть обеспечено исключительно пероральной формой регидратации [20]. Одним из важных направлений совершенствования терапии больных с острыми кишечными инфекциями должна являться целенаправленная образовательная деятельность, направленная на повышение уровня осведомленности практикующих врачей в области современных возможностей регидратационной терапии [1]. Абсорбция электролитов Ионы Na+ поступают в энтероциты через апикальную поверхность цитоплазматической мембраны преимущественно через изоформу 3 Na+/H+ обменника (Na+/H+ exchanger isoforma 3 — NHE3), а ионы Cl– — в обмен на анион бикарбоната через анионный антипортер SLC26A3 (solute carrier family 26, member 3), известный как обменник (эксченджер), экспрессия которого снижена в ткани аденомы (downregulated in adenoma — DRA). Чтобы попасть в кровеносное русло, ионы натрия и хлора высвобождаются из клетки в регионе базолатеральной поверхности их цитоплазматической мембраны. Ионы Na+ высвобождаются при помощи Na+/K+ АТФазы, в то время как ионы Cl– — через кальций-активируемый хлоридный канал (chloride channel accessory — CLCA) и Cl–/HCO–3 обменник (эксченджер) (рис. 1). В дистальных отделах толстой кишки абсорбция ионов Na+ из просвета кишечника происходит через эпителиальный натриевый канал (epithelial sodium channel — ENaC). Существуют и другие трансмембранные транспортеры, которые участвуют в абсорбции электролитов, например, изоформы 2 Na+/H+ обменника (NHE2) [18, 21].
Секреция электролитов Ионы Cl– из межклеточного пространства попадают в клетку через электронейтральный котранспортер NKCC1 (Na+/K+/2Cl– cotransporter 1-a), который находится исключительно на базолатеральной поверхности цитоплазматической мембраны энтероцитов. Энергетические потребности для активной секреции ионов Cl– обеспечивает Na+/K+ АТФаза, которая, взаимодействуя с тремя ионами Na+, гидролизирует одну молекулу АТФ. Na+/K+ АТФаза транспортирует три иона Na+ из клетки, а два иона К+ — в клетку, в результате чего во внеклеточной среде создается высокая концентрация ионов Na+, а во внутриклеточной — высокая концентрация ионов K+, которая способствует продвижению ионов Cl– в цитоплазме от базолатеральной к апикальной поверхности мембраны клетки. Через апикальную поверхность цитоплазматической мембраны клетки ионы Cl– высвобождаются в просвет кишечника при помощи трансмембранного регуляторного белка муковисцидоза (cystic fibrosis transmembrane regulator — CFTR), который преимущественно экспрессируется энтероцитами крипт и в меньшей степени — эпителиоцитами ворсинок (рис. 2). Через CFTR кишечного эпителия секретируется также бикарбонат-анион [18, 21]. CFTR является цАМФ-активируемым каналом Cl–, который был впервые клонирован John R. Riordan и соавт. [13] в 1989 году и изменил не только представление о транспорте ионов хлора, но и концепцию патогенеза муковисцидоза. Процессы абсорбции и секреции электролитов происходят одновременно и регулируются сопряженными механизмами. Абсорбция и секреция воды Абсорбция воды преимущественно связана с транспортным вектором ионов Na+ — от апикальной к базолатеральной поверхности мембраны энтероцитов, т.е. из просвета кишечника в просвет кровеносных сосудов, в то время как секреция воды ассоциирована преимущественно с транспортным вектором ионов Cl– — от базолатеральной к апикальной поверхности мембраны энтероцитов, т.е. из просвета кровеносных сосудов в просвет кишечника. Перемещение воды может происходить и через парацеллюлярное пространство, просвет которого регулируется тесными межклеточными контактами. Эпителиоциты кишечника экспрессируют несколько аквапоринов AQP3, AQP4, AQP6, AQP7 и AQP8, но их роль в кишечнике изучена недостаточно [7, 18]. В патогенетической основе диареи лежат патоген-индуцированные изменения в направлении движения ионов и воды через эпителиальный пласт слизистой оболочки кишечника, проявляющиеся преобладанием активности секреции над потенциальными возможностями механизмов реабсорбции, что приводит к существенному увеличению объема жидкости в просвете кишечника. В настоящее время выделяют три патогенетических варианта диареи: инвазивный, секреторный и осмотический. Обезвоживание развивается, как правило, при секреторном и осмотическом типе диареи [5, 15]. Секреторная диарея характерна для большинства диарей, протекающих с поражением тонкого кишечника. Инфекционные кишечные агенты могут способствовать увеличению объема жидкости в просвете кишечника, как непосредственно, модулируя процессы переноса ионов эпителиальными клетками и изменяя уровень барьерной функции эпителия слизистой оболочки, так и косвенно, вследствие развития воспаления, индукции синтеза нейропептидов или уменьшения площади эпителиальной поверхности, поглощающей жидкость. Так, кишечные инфекционные патогены, модулируя активность трансмембранных молекулярных транспортеров — SGLT1, NHE3, Cl–/HCO–3, CFTR, CLCA, DRA, усиливают секрецию в просвет кишечника ионов Cl– и воды секреторными клетками кишечных крипт и подавляют абсорбцию из просвета кишечника ионов Na+ и глюкозы клетками ворсинок. Нарушение тесных межклеточных контактов обусловливает усиление перемещения тканевой жидкости через парацеллюлярное пространство в просвет кишечника. Уменьшение экспрессии аквапоринов также приводит к снижению объема всасывания жидкости из внутрикишечного пространства (рис. 3). Увеличение объема воды в просвете кишечника обуславливает развитие диареи [12].
Метод ПРТ был разработан после открытия тесной взамосвязи транспортных механизмов натрия и глюкозы в энтероцитах. Было показано, что ионы Na+ более эффективно всасываются из просвета кишечника транспортером SGLT1 в присутствии глюкозы или галактозы. Существует представление, что транспортер SGLT1 характеризуется наличием поверхностного воротного протеина, связывающего глюкозу на входе в транспортную систему, и двух параллельных взаимодействующих каналов — для ионов натрия и глюкозы. Исходно глюкозный и натриевый каналы находятся в неактивном состоянии. При связывании глюкозы с аллостерическим центром воротного протеина активируется натриевый канал, и ионы Na+ транслоцируются через мембрану клетки в интрацеллюлярное пространство. На определенном этапе движения ионов Na+ по каналу происходит активация трансмембранного глюкозного канала, через который начинает транспортироваться первоначально зафиксированная на воротном устройстве молекула глюкозы. Освобождение воротного протеина от молекулы глюкозы приводит к дезактивации натриевого канала. Перемещение ионов натрия создает осмотический градиент, в связи с чем происходит пассивное передвижение молекул воды в клетку. Таким образом, всасывание воды является вторичным по отношению к активному транспорту натрия и глюкозы. Стехиометрия транспорта Nа+: глюкоза: Н2О составляет 2: 1: 210 (рис. 4) [4].
Этот мощный механизм обеспечивает всасывание половины суточного количества воды из тонкой кишки. Механизм сотранспорта ионов Na+ и глюкозы является физиологической основой для аргументации применения ПРТ при купировании секреторной диареи. Ионы Na+, вошедшие в клетку вместе с глюкозой через мембрану щеточной каймы (транспортер SGLT1), выкачиваются в кровь через базолатеральную мембрану 3Na+/2K+-насосом, а глюкоза через базолатеральную мембрану транспортируется в кровь за счет облегченной диффузии [4]. Растворы, предназначенные для ПРТ, содержат в оптимальном соотношении ионы натрия и глюкозу, что обеспечивает максимальный уровень всасывания натрия и воды в кишечнике [12]. Осмотическая диарея характерна для вирусных диарей, которые сопровождаются избыточным скоплением различных веществ в полости кишечника. Характерное вирус-индуцированное поражение энтероцитов ворсинок слизистой оболочки кишечника обусловливает развитие дисахаридазной, преимущественно лактозной, недостаточности, которая приводит к избыточному накоплению веществ с высокой осмотической активностью, предопределяя повышение осмолярности химуса и передвижение воды из низкоосмолярной межклеточной жидкости в просвет кишечника. Увеличение объема «водянистого» химуса ведет к возникновению диареи. Применение гипоосмолярных растворов при осмотической диарее позволяет снизить гиперосмолярность химуса [5, 15]. Растворы для ПРТ На протяжении более чем двадцатилетней истории использования ПРТ происходило постоянное усовершенствование данного метода лечения — от рекомендаций 1981 года, постулировавших использовать исключительно официнальные регидратирующие растворы, до признания возможности применения так называемых домашних жидкостей в случаях диарей, протекающих без выраженного токсикоза [11, 19, 23]. Также первично для лечения диарей были рекомендованы растворы (так называемые растворы первого поколения, например, ОРС/оралит), которые обладают более высоким уровнем осмолярности (331 мОсм/л), чем плазма крови (285–295 мОсм/л). Однако впоследствии было показано, что они в определенной степени задерживают всасывание раствора в просвете кишечника [1]. Несмотря на то что растворы первого поколения достаточно эффективно способствуют регидратации и купируют метаболический ацидоз, в мае 2004 года ВОЗ и Детский фонд ООН (ЮНИСЕФ) опубликовали новые рекомендации по контролю за эпизодами диареи у детей, в которых было обосновано применение гипоосмолярных растворов (до 245 мОсм/л) с более низкой концентрацией хлорида натрия (до 75 ммоль/л) и глюкозы (до 75 ммоль/л) (табл. 2) [26].
Краткая характеристика некоторых официнальных растворов второго поколения — гастролита (Teva), гидровита (Stada), морковно-рисового отвара ОRS 200 (Hipp), регидрона (Orion Corporation), хуманы электролита с банановым вкусом (Humana), хуманы электролита с фенхелем (Humana), применяемых в настоящее время у детей для проведения ПРТ, представлена в табл. 2. В большом многоцентровом сравнительном исследовании эффективности ПРТ у 675 детей с острой диареей, получавших внутрь растворы различной осмолярности, было показано, что при применении гипоосмолярных растворов достоверно реже возникали ситуации, которые требовали парентеральной формы регидратации. Частота возникновения гипонатриемии не зависела от осмолярности применяемых растворов (отношение шансов 1,3, 95% доверительный интервал 0,2–2,2). Присутствие бикарбонатов и/или цитратов в растворе ПРТ способствует более быстрой коррекции метаболического ацидоза [9]. В последнее время ПРТ рекомендуют сочетать с назначением препаратов цинка. В систематическом обзоре и метаанализе Marzia Lazzerini и Luca Ronfani [16, 17] было показано, что сочетанное назначение пероральной регидратации и препаратов цинка детям в возрасте от шести месяцев до пяти лет при инфекционной диарее способствует достоверному сокращению продолжительности заболевания на 12,3–15,8 ч. Согласно данным ВОЗ, назначение цинка в дозе 10–20 мг в день на протяжении 10–14 дней снижает риск повторного развития диареи в течение последующих двух-трех месяцев [26]. Саногенетическое влияние цинка при лечении диареи обусловлено его способностью усиливать всасывание воды и электролитов в кишечнике, ускорять регенерацию эпителия кишечника, повышать уровень активности ферментов щеточной каемки микроворсинок энтероцитов и модулировать иммунный ответ [23]. Заключение Таким образом, применение ПРТ является физиологическим, эффективным и безопасным методом патогенетического лечения детей с острыми кишечными инфекциями, которые протекают с явлениями эксикоза. ПРТ должна использоваться у всех детей с острыми кишечными инфекциями при дегидратации легкой и средней степени тяжести. Назначение ПРТ способствует более быстрому выздоровлению и предупреждает неблагоприятные исходы заболевания. При выборе перорального раствора предпочтение должно отдаваться официнальным гипотоническим растворам. Сочетание ПРТ с назначением препаратов цинка повышает эффективность лечения. При проведении ПРТ необходимо постепенное, но максимально быстрое возобновление диеты.
Список литературы / References 1. Захаренко С.М. Пероральная регидратационная терапия при острых кишечных инфекциях // Журнал инфектологии. — 2009. — Т. 1, № 2–3. — С. 58-63. 2. Крамарев С.А., Закордонец Л.В. Ротавирусная инфекция: эпидемиология и профилактика // Здоровье ребенка. — 2011. — № 1 (28). 3. Мазанкова Л.Н., Ильина Н.О. Ротавирусная инфекция у детей на современном этапе: клиника, диагностика, лечение // Вопросы практической педиатрии. — 2010. — Т. 5, № 6. — С. 43-49. 4. Метельский С.Т. Физиологические механизмы всасывания в кишечнике. Основные группы веществ // РЖГГК. — 2009. — № 4. — С. 55-61. 5. Хаертынов Х.С., Анохин В.А. Современные принципы терапии острых кишечных инфекций у детей раннего возраста // Казанский медицинский журнал. — 2010. — Т. 91, № 1. — С. 1-6. 6. Acra S.A., Ghishan G.K. Electrolyt e fluxes in the gut and oral rehydration solutions // Pediatr. Clin. North Am. — 1996. — Vol. 43, № 2. — P. 433-449. 7. Aquaporins in the digestive system / T. Matsuzaki, Y. Tajika, A. Ablimit, T. Aoki, H. Hagiwara, K. Takata // Med. Electron. Microsc. — 2004. — Vol. 37, № 2. — P. 71-80. 8. Bhutta Z.A. Acute gastroenteritis in children / R. Kliegman, R. Behrman, H. Jenson, B. Stanton, ed. // Nelson text book of pediatrics. — 18th ed. — Saundres, 2008. — P. 1614. 9. CHOICE Study Group. Multicenter, randomized, double-blind clinical trial to evaluate the efficacy and safety of a reduced osmolarity oral rehydration salts solution in children with acute watery diarrhea // Pediatrics. — 2001. — Vol. 107, № 4. — P. 613-618. 10. Claeson M., Merson M.H. Global progress in the control of diarrheal diseases // Pediatr. Infect. Dis. J. — 1990. — Vol. 9, № 5. — P. 345–355. 11. Farthing M.J. Oral rehydration: an evolving solution // J. Pediatr. Gastroenterol. Nutr. — 2002. — Vol. 34 (suppl.). — P. S64-S67. 12. Hodges K., Gill R. Infectious diarrhea: Cellular and molecular mechanisms // Gut Microbes. — 2010. — Vol. 1, № 1. — P. 4-21. 13. Identification of the cystic fibrosis gene: cloning and characterization of complementary DNA / J.R. Riordan, J.M. Rommens, B. Kerem, N. Alon, R. Rozmahel, Z. Grzelczak, J. Zielenski, S. Lok, N. Plavsic, J.L. Chou, L.M. Drumm, M.C. Iannuzzi, F.S. Collins, L.-C. Tsui // Science. — 1989. — Vol. 245, № 4922. — P. 1066-1073. 14. King C.K., Glass R., Bresee J.S., Duggan C. Managing acute gastroenteritis among children: oral rehydration, maintenance, and nutritional therapy // MMWR Recomm. Rep. — 2003. — Vol. 52 (RR-16). — P. 1-16. 15. Koletzko S., Osterrieder S. Acute infectious diarrhea in children // Dtsch. Arztebl. Int. — 2009. — Vol. 106, № 33. — P. 539-547. 16. Lazzerini M., Ronfani L. Oral zinc for treating diarrhoea in children // Cochrane Data base Syst. Rev. — 2008. — Vol. 3. — CD005436. 17. Lazzerini M., Ronfani L. Oral zinc for treating diarrhoea in children // Sao Paulo Med. J. — 2011. — Vol. 129, № 2. — P. 118-119. 18. Molecular bases of impaired water and ion movements in inflammatory bowel diseases / O. Martínez-Augustin, I. Romero-Calvo, M.D. Suárez, A. Zarzuelo, F.S. de Medina // Inflamm. Bowel. Dis. — 2009. — Vol. 15, № 1. — P. 114-127. 19. Mouterde O. Solutions de réhydratation orale et diarrhée aiguë: état des lieux // Arch. Pediatr. — 2007. — Vol. 14 (suppl. 3). — P. S165-S168. 20. Munos M.K., Walker C.L., Black R.E. The effect of oral rehydration solution and recommended home fluids on diarrhoea mortality // Int. J. Epidemiol. — 2010. — Vol. 39 (suppl. 1). — P. i75-i87. 21. Murek M., Kopic S., Geibel J. Evidence for intestinal chloride secretion // Exp. Physiol. — 2010. — Vol. 95, № 4. — P. 471-478. 22. Pan American Health Organization, World Health Organization. Integrated Management of Childhood Illness (IMCI) // Final report of the 26th Pan American Sanitary Conference; 23–27 September 2002; Washington, D.C, USA. Washington, D.C.: OPAS/OMS. — 2002. — P. 17-18. 23. Telmesani A.M. Oral rehydration salts, zinc supplement and rota virus vaccine in the management of childhood acute diarrhea // J. Family Community Med. — 2010. — Vol. 17, № 2. — P. 79-82. 24. Uchendu U.O., Emodi I.J., Ikefuna A.N. Pre-hospital management of diarrhoea among caregivers presenting at a tertiary health institution: implications for practice and health education // Afr. Health Sci. — 2011. — Vol. 11, № 1. — P. 41-47. 25. Victora C.G., Bryce J., Fontaine O., Monasch R. Reducing deaths from diarrhoea through oral rehydration therapy // Bull World Health Organ. — 2000. — Vol. 78, № 10. — P. 1246-1255. 26. WHO/UNICEF. WHO-UNICEF Joint statement on the clinical management of acute diarrhea. — Geneva, Switzerland: World Health Assembly, 2004. Введение Инфекции мочевыводящих путей (ИМП) являются наиболее распространенными заболеваниями среди детского и взрослого населения. Многочисленные исследования показывают, что инфекции мочевыводящих путей устойчиво занимают второе место по распространенности среди бактериальных инфекций. Каждый год в мире регистрируется около 150 миллионов случаев ИМП у мужчин и женщин всех возрастов [5]. В первые 6–12 месяцев после первого эпизода ИМП риск рецидивирования заболевания у детей составляет 12–30 % [15]. Рецидивирующее течение инфекции у детей и взрослых может привести к обструкции мочевыводящих путей и развитию хронической почечной недостаточности [3]. Наиболее частым возбудителем ИМП у детей всех возрастных групп является кишечная палочка. При впервые обнаруженной инфекции мочевой системы Esherichia сoli выявляется в 60–92 % случаев. Другими наиболее частыми причинно-значимыми патогенами являются Staphylococcus saprophyticus, Klebsiella, Proteus, Enterococcus, Enterobacter [2, 9, 30]. Инфицирование мочевыводящих путей происходит восходящим путем или транслокацией уропатогенов из исходного биотопа (кишечник, миндалины, зубы и т.д.) в почки. Колонизация уропатогенами характеризуется преодолением микроорганизмами иммунобиологических барьеров хозяина и их закреплением в ткани мочевыводящих путей, в том числе на канальцевом и чашечно-лоханочном уроэпителии [8]. Заключение Таким образом, ранняя диагностика инфекций мочевыводящих путей у детей представляет собой достаточно сложную задачу, с которой часто сталкивается врач-педиатр и семейный врач. Использование скрининг-тестов и алгоритмов диагностики позволяет своевременно устанавливать диагноз инфекций мочевыводящих путей даже в малосимптомных клинических ситуациях. Увеличение доли уропатогенных бактериальных штаммов, обладающих устойчивостью к антибактериальной терапии, в этиологической структуре инфекций мочевыводящих путей у детей обусловливает необходимость использования антибактериальных препаратов, которые содержат ингибиторы b-лактамаз, в частности Сульбактомакса.
Список литературы / References 1. Загородній М.П., Понор О.Б., Маркевич В.Е. П
|
||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 231; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.195.4 (0.013 с.) |