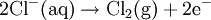Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства катиона водорода.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В отличие от водорода, катион водорода, или протон Н+, не имеет электронов и поэтому всегда выступает только окислителем. В водных растворах кислот, где концентрация катионов водорода достаточно велика, активные и средней активности Ме, т.е. Ме, стоящие в ряду напряжений левее водорода, легко им окисляются: Zn + H2SO4(разб.) = ZnSO4 + H2↑ При взаимодействии кислот, в которых окислителем является катион Н+, с Ме с переменной степенью окисления (Fe, Cr), образуются соли, содержащие Ме в его низшей степени окисления, вследствие невысокой окислительной способности катиона водорода: Fe + 2HCl = FeCl2 + H2↑ Чистая вода содержит катионы водорода в чрезвычайно низкой концентрации, и поэтому она реагирует только с активными Ме: 2Na + 2H2O = 2NaOH + H2↑ Металлы, оксиды и гидроксиды которых амфотерны, взаимодействуют с водными растворами щелочей, где вначале происходит растворение защитной оксидной пленки на их поверхности, а затем очищенный Ме взаимодействует с молекулами воды, образуя гидроксокомплекс и молекулярный водород: 2Al + 6NaOH + 6H2O = 2 Na3[Al(OH)6] + 3H2↑ В лабораториях водород получают действием сильных кислот на активные Ме, чаще всего на цинк: Zn + 2HCl = ZnCl2 + H2↑ В промышленности водород получают железо-паровым методом или пропусканием паров воды над раскаленным углем (коксом): 3Fe + 4H2O = 4H2↑ + Fe3O4 (FeO*Fe2O3); C + H2O = CO↑ + H2↑ Очень чистый водород получают электролизом воды: 2H2O + эл. ток = O2(на аноде) + 2Н2(на катоде)
Вода
Оксид водорода Н2О. в молекуле воды атом кислорода находится в состоянии sp3-гибридизации. Две его гибридные sp3-орбитали, содержащие неспаренные электроны, участвуют в образовании двух полярных связей с атомами водорода, а две оставшиеся заняты неподеленными электронными парами атома кислорода. Благодаря двум атомам водорода, несущим частичный положительный заряд, и двум неподеленным электронным парам, каждая молекула воды может образовывать четыре водородные связи с четырьмя соседними молекулами воды. Высокая диэлектрическая проницаемость воды способствует растворению и диссоциации на ионы солей, кислот и оснований. Все ионы вступают в ион-дипольное взаимодействие с полярными молекулами воды и в результате вокруг каждого иона образуются гидратные оболочки. Силы взаимодействия ионов с молекулами воды гидратных оболочек настолько велики, что они существуют не только в растворах, но и частично сохраняются в некоторых кристаллах в виде кристаллогидратов: CuSO4*5H2O, Na2SO4*10H2O, FeCl3*6H2O.
Вода является растворителем и стабилизатором молекул и ионов. В живых организмах она транспортирует питательные вещества в клетки, сохраняет внутриклеточное давление и форму клеток, участвует в синтезе и гидролизе биологических субстратов, является регулятором теплового баланса. Большое количество воды в живом организме внутри и вне клеток (70%) указывает на то, что вода не просто необходима для жизни, она – сама жизнь. Вода имеет важное и разнообразное применение и в технике, и в промышленности.
Химические свойства воды.
Вода – чрезвычайно слабый электролит. При ее диссоциации образуется очень мало катионов водорода Н+ и анионов ОН-, концентрация которых в чистой воде равны между собой и при 220С составляют 10-7 моль/л. наличие в системе одновременно и носителя кислотных свойств катиона Н+, и основных свойств – аниона ОН- в равных количествах делает воду типичным амфолитом с четко сбалансированными кислотно-основными свойствами. Так, при взаимодействии с различными оксидами ее молекула выступает как амфолит: Н-ОН + SO3 = H2SO4 H-OH + CaO = Ca(OH)2 В процессе гидролиза солей вода, которая в целом является «идеальным» амфолитом, может выступать и как кислота, и как основание – в зависимости от объекта гидролиза (анион или катион). При гидролизе соли по аниону молекула воды отдает аниону соли катион водорода, т.е. она является кислотой. При этом образуется новая слабая кислота: NO2- + H+ - OH- ↔ HNO2 + OH- При гидролизе соли по катиону молекула воды отдает этому катиону анион ОН-, выступая основанием. При этом образуется слабое основание: Cu2+ + H+ - OH- ↔ (CuOH)+ + H+ В окислительно-восстановительных реакциях вода также может проявлять двойственный характер – либо окислитель за счет Н+, либо восстановитель за счет О2-. Наличие в молекуле воды у атома кислорода неподеленных электронных пар делает ее активным лигандом, образующим с катионами d-металлов устойчивые комплексные ионы: [Zn(H2O)4]2+, [Cu(H2O)4]2+, [Fe(H2O)6]3+, [Cr(H2O)6]3+. Наличие таких ионов в водных растворах придает им определенный цвет, характерный для данного комплексного иона.
Задачи и упражнения для самостоятельной работы 1. Даны вещества: Н2, О2, Zn, HCl, CuO. Составьте уравнения всех возможных реакций этих веществ между собой. 2. Приведите примеры образования водорода в результате реакций: а) разложения; б) замещения. 3. Одинаковое ли количество воды образуется при восстановлении водородом 10 г оксида меди (I) и 10 г оксида меди (II)? Ответ подтвердите расчетом. 4. Какова: а) плотность воздуха по водороду; б) плотность водорода по воздуху? 5. При растворении в кислоте 2,33 г смеси железа и цинка было получено 896 мл водорода (н.у.). сколько граммов железа и цинка содержалось в смеси? 6. Какую роль – окислителя или восстановителя – играет пероксид водорода в каждой из следующих реакций: KNO2 + H2O2 = KNO3 + H2O; KMnO4 + H2O2 + HNO3 = Mn(NO3)2 + O2 + KNO3 + H2O? Составьте уравнение второй реакции методом электронного баланса. 7. Какой объем водорода (н.у.) потребуется для восстановления оксида меди (II), полученного при термическом разложении 19,6 г гидроксида меди (II)? 8. На нейтрализацию раствора, полученного при взаимодействии гидрида кальция с водой, затратили раствор объемом 43,67 мл с массовой долей хлороводорода29,2% и плотностью 1,145 г/мл. какой объем водорода (н.у.) выделился при разложении гидрида? 9. При обработке образца смеси цинка и железа хлороводородной кислотой выделилось 0,896 л водорода, а при действии раствора щелочи на такой же образец смеси – 0,448 л водорода. Определите массовые доли (%) компонентов в смеси.
Глава VII. Галогены Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены— энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьшается. К галогенам относятся фторF, хлорCl, бромBr, йодI, астатAt, а также (формально) искусственный элемент унунсептийUus.
Все галогены— неметаллы. На внешнем энергетическом уровне 7электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательнымиэлементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7. Как уже было сказано выше, галогены имеют высокую реакционную способность, поэтому встречаются в природе обычно в виде соединений. Их распространённость в земной коре уменьшается при увеличении атомного радиуса от фтора к йоду. Количество астата в земной коре измеряется граммами, а унунсептий в природе отсутствует. Фтор, хлор, бром и йод производятся в промышленных масштабах, причем хлор производится в гораздо больших количествах. В природе эти элементы встречаются в основном в виде галогенидов(за исключением йода, который также встречается в виде йодата натрия или калия в месторождениях нитратов щелочных металлов). Н2 + Br2 = 2HBr(г) + 73 кДж. Поскольку многие хлориды, бромидыи иодидырастворимыв воде, то эти анионыприсутствуют в океане и природных рассолах. Основным источником фтора является фторид кальция, который очень малорастворими находится в осадочных породах (какфлюоритCaF2). Основным способом получения простых веществявляется окислениегалогенидов. Впервые фтор был получен в1886г.французским химиком Анри Муассаномпри электролизераствора гидрофторида калия KHF2 в безводной плавиковой кислоте.
В лабораторных условиях хлор получают из соляной кислоты при взаимодействии ее с оксидом марганца (IV) при нагревании: 4HCl + MnO2 = Cl2 + MnCl2 + 2H2O Вместо окислителя MnO2 можно применить перманганат калия. Реакция протекает при обычной температуре: 16HCl + 2KMnO4 = 5Cl2 + 2MnCl2 + 2KCl + 8H2O В промышленности хлор в основном получают электролизом водного раствора хлорида натрияв специальных электролизёрах. При этом протекают следующие реакции: полуреакция на аноде: Бромполучают химическим окислением бромид-иона, находящегося в морской воде. Подобный процесс используется и для получения йодаиз природных рассолов, богатых I−. В качестве окислителя в обоих случаях используют хлор, обладающий более сильными окислительными свойствами, а образующиеся Br2 и I2 удаляются из раствора потоком воздуха.
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1358; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.128.229 (0.013 с.) |