Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теория Гейтлера – Лондона. Метод валентных связей (МВС).Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
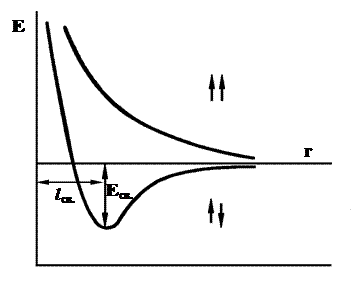
В 1927 году В.Гейтлер и Ф.Лондон произвели приближенный расчет молекулы водорода. Вначале они рассмотрели систему из двух атомов водорода, находящихся на большом расстоянии друг от друга и выразили зависимость волновой функции рассматриваемой системы от координат. Далее они предположили, что найденная зависимость сохраняется и при сближении атомов водорода. В результате они получили уравнения, позволяющие найти зависимость потенциальной энергии системы, состоящей из двух атомов водорода, от расстояния r между ядрами этих атомов. Оказалось, что при совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы, т.е. связь не образуется. При противоположно направленных спинах сближение атомов до некоторого расстояния r0 приводит к снижению энергии системы. При r = r0 система обладает минимальной потенциальной энергией, т. е. находится в самом устойчивом состоянии – образуется связь. Дальнейшее сближение атомов приводит к возрастанию энергии. Таким образом, lcв соответствует длине связи, а выделяющаяся при этом энергия (Есв – энергии связи. Полученные расчетные значения оказались близки к экспериментально найденным величинам. Для молекулы водорода энергия связи составляет 430,9 кДж/моль, а длина связи 0,74Å, что совпадает с экспериментальными данными.
Рис 1.График изменения энергии системы, образующейся при сближении двух атомов водорода
Поскольку длина связи меньше суммы радиусов двух атомов водорода (0,53·2=1,06Å). Это позволяет сделать вывод, что при возникновении ковалентной связи происходит перекрывании электронных облаков с образованием молекулярного электронного облака, сопровождающееся уменьшением энергии.
Механизм образования связей. Согласно методу ВС химическую связь образуют два электрона с противоположными спинами (связь двухцентровая и двухэлектронная). Например, образование молекулы F2 по методу ВС представляется следующим образом:
Каждая пара атомов в молекуле удерживается при помощи одной или нескольких электронных пар, образующихся за счет двух электронов, которые до образования связи принадлежали разным атомам. В случае образования нескольких электронных пар возникают кратные связи. Например, в молекуле азота осуществляется трехкратная связь NºN, каждый атом приобретает устойчивую восьмиэлектронную оболочку.
Возможен и другой механизм образования ковалентной связи за счет неподеленных электронных пар одного атома А (донора) и свободных орбиталей другого В (акцептора):
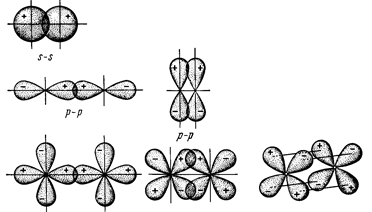
Такая связь называется донорно-акцепторной и отличается от обычной ковалентной связи только происхождением электронной пары. Число общих электронных пар, связывающих атом данного элемента с другими атомами (число образуемых атомом ковалентных связей), называется ковалентностью элемента в данном соединении. Например, в молекулах СН4 и СО2 ковалентность углерода равна четырем, водорода – единице, а кислорода – двум. Связь образуется путем перекрывания электронных облаков взаимодействующих атомов (длина связи меньше суммы радиусов взаимодействующих атомов). Чем в большей степени перекрываются взаимодействующие электронные облака, тем прочнее ковалентная связь Ковалентная связь насыщаема и направлена. Насыщаемость связи - полное использование валентных возможностей атома. Количество связей, которое может образовать атом (его ковалентность), определяется количеством неспаренных электронов в основном и возбужденном состояниях атома. Ковалентность может быть повышена также за счет образования дополнительных донорно-акцепторных связей. Например, в молекуле СО количество связей равно трем: две связи образуются за счет объединения неспаренных р-электронов углерода и кислорода, а третья – за счет неподеленной электронной пары кислорода (донор) и свободной квантовой ячейки углерода (акцептор). Валентные возможности атомов. Нормальное и возбужденное состояния. (см. главу «Периодический закон и периодическая система Д.И.Менделеева») Направленность связи. Поскольку перекрывающиеся облака определенным образом направлены в пространстве, возникающая химическая связь имеет направленный характер. Различают s-, p- и d - связи. s - связи получаются в результате взаимного перекрывания орбиталей вдоль линии, соединяющей центры атомов. p-связи возникают при перекрывании орбиталей в направлении, перпендикулярном линии связи.
d-связи возникают при перекрывании всех четырех лепестков d-орбиталей в параллельных плоскостях (рис. 2):
Рис. 2 Схема перекрывания орбиталей при образовании s-, p-, d-связей
Таким образом, s-орбитали образуют только s-связи; р-орбитали s- и p ‑связи; а d–орбитали – s-, p- и d-связи. Эти связи различаются по энергии: Еs-связи> Еp-связи> Еd-связи Итак, согласно методу ВС ковалентная химическая связь – двуцентровая, двухэлектронная, локализованная, направленная и насыщенная. Геометрия и свойства молекул, образующихся из нормального состояния атомов Молекулы типа А2: H2, O2, N2 линейные, неполярные. Кратность связи равна 1,2,3 соответственно. Они образуются двумя одинаковыми атомами, между которыми могут возникать: - одна одинарная σ- связь, за счет перекрывания двух s-(молекулы Н2) или двух р- орбталей (молекулы Cl2), - двукратная связь – одна σ- и одна π- связи (молекулы О2), - трехкратная - одна σ- и две π- связи (молекулы N2).
Рис.3 Формы молекул: а – линейная (А2, АВ); б – угловая (АВ2); в – пирамидальная (АВ3)
Молекулы типа АВ: HF, HCl, HBr, HI линейные, полярные. Свойства связей в молекулах типа АВ
Молекулы типа А2В: H2O, H2S, H2Se, H2Te, H2Po угловые (α ≥ 90˚), полярные. На рисунке 4 представлена схема образования молекулы Н2Те – два р-облака теллура перекрываются s – орбиталями двух атомов водорода:
Рис.4 Схема образования связей в молекуле Н2Tе В ряду: H2O, H2S, H2Se, H2Te, H2Po Длина связи возрастает Энергия связи уменьшается Полярность связи уменьшается Угол между связями уменьшается Молекулы типа АВ3: NH3, PH3, AsH3, SbH3 имеют форму тригональной пирамиды, (α ≥ 90˚), полярные. На рисунке представлена схема образования молекулы SbH3 – три орбитали атома сурьмы перекрываются с тремя s – обиталями трех атомов водорода с образованием полярных σ – связей. Образующаяся молекула имеет пирамидальное строение с углом между связями ≈ 900 . Молекула полярна.
Рис.5 Схема образования связей в молекуле SbН3 Cвойства связей в молекулах типа АВ3
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 557; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.147.225 (0.011 с.) |