
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Полярная и неполярная ковалентная связьСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Ковалентная неполярная связь – связь между атомами с одинаковой ЭО, когда общие электронные пары находятся на одинаковом расстоянии от обоих взаимодействующих атомов и в равной степени принадлежат им обоим. Ковалентная полярная связь – связь между атомами с незначительно различающейся ЗО, когда общие электронные пары смещены в сторону более ЭО химического элемента (разность ЭО < 1,7). Гибридизация электронов Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам. Виды гибридизации [править]sp-гибридизация
sp-гибридизация Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов. [править]sp2-гибридизация
sp2-гибридизация Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей [править]sp3-гибридизация
sp3-гибридизация Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов. Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов. Гибридизация и геометрия молекул Представления о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии. В таблице приведены примеры соответствия наиболее распространённых типов гибридизации и геометрической структуры молекул в предположении, что все гибридные орбитали участвуют в образовании химических связей (отсутствуют неподелённые электронные пары)[1].
Свойства гибридизированных ковалентных связей Сигма и пи связь
Дипольный момент
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1042; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.50.1 (0.01 с.) |



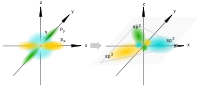






 Рис. 1. Схематическое изображение пространственной ориентации орбиталей при образовании s-связи в результате s — s-, s — ps-, ps — ps-взаимодействий (а) и p-связи в результате pp —, pp —, dp — dp — взаимодействий (б).
Рис. 1. Схематическое изображение пространственной ориентации орбиталей при образовании s-связи в результате s — s-, s — ps-, ps — ps-взаимодействий (а) и p-связи в результате pp —, pp —, dp — dp — взаимодействий (б).  Рис. 2. Схематическое изображение облаков px-, ру-, pz- электронов. Показаны оси декартовых координат и узловые плоскости px- и ру-орбиталей.
Рис. 2. Схематическое изображение облаков px-, ру-, pz- электронов. Показаны оси декартовых координат и узловые плоскости px- и ру-орбиталей.



