
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ряды, периоды, группы, подгруппы (s- p- d- f- элементы)Содержание книги
Поиск на нашем сайте
Каждый элемент занимает определённое место (клетку) в периодической системе и имеет свой порядковый (атомный) номер. Например:
Горизонтальные ряды элементов, в пределах которых свойства элементов изменяются последовательно, Менделеев назвал периодами (начинаются щелочным металлом (Li, Na, K, Rb, Cs, Fr) и заканчиваются благородным газом (He, Ne, Ar, Kr, Xe, Rn)). Исключения: первый период, который начинается водородом и седьмой период, который является незавершённым. Периоды разделяются на малые и большие. Малые периоды состоят из одного горизонтального ряда. Первый, второй и третий периоды являются малыми, в них находится 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды). Большие периоды состоят из двух горизонтальных рядов. Четвёртый, пятый и шестой периоды являются большими, в них находятся 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й, 7-й период). Верхние ряды больших периодов называются чётными, нижние ряды – нечётными. В шестом периоде лантаноиды и в седьмом периоде актиноиды располагаются в нижней части периодической системы. В каждом периоде слева направо металлические свойства элементов ослабевают, а неметаллические свойства усиливаются. В чётных рядах больших периодов находятся только металлы. В результате в таблице имеется 7 периодов, 10 рядов и 8 вертикальных столбцов, названных группами – это совокупность элементов, которые имеют одинаковую высшую валентность в оксидах и в других соединениях. Эта валентность равна номеру группы. Исключения:
В VIII группе только Ru и Os имеют высшую валентность VIII. Группы - вертикальные последовательности элементов, они нумеруется римской цифрой от I до VIII и русскими буквами А и Б. Каждая группа состоит из двух подгрупп: главной и побочной. Главная подгруппа – А, содержит элементы малых и больших периодов. Побочная подгруппа – В, содержит элементы только больших периодов. В них входят элементы периодов, начиная с четвёртого.
В главных подгруппах сверху вниз металлические свойства усиливаются, а не металлические свойства ослабляются. Все элементы побочных подгрупп являются металлами. Квантовые числа Главное квантовое число n определяет полную энергию электрона. Каждому числу соответствует энергетический уровень. n=1,2,3,4…или K,L,M,N… Орбитальное квантовое число l определяет подуровни на энергетическом уровне. Квантовое число l определяет форму орбиталей (n-1) 0,1,2… Магнитное квантовое число ml определяет число орбиталей на подуровне. …-2,-1,0,+1,+2… Общее число орбиталей на подуровне равно 2l+1 Спиновое квантовое число ms относится к двум различным ориентациям +1/2 -1/2 на каждой орбитали может быть только два электрона с противоположными спинами. Правило заполнения энергетических уровней и под уровней элементов периодической системы Первое правило Клечковского: при увеличении заряда ядра атомов заполнение энергетических уровней происходит от орбиталей с меньшим значением суммы главного и орбитального * квантовых чисел (n+l) к орбиталям с большим значением этой суммы. Следовательно, 4s-подуровень (n+l=4) должен заполняться раньше, чем 3d (n+l=5). Второе правило Клечковского, согласно которому при одинаковых значениях суммы (n+l) орбитали заполняются в порядке возрастания главного квантового числа n. Заполнение 3d-подуровня происходит у десяти элементов от Sc до Zn. Это атомы d-элементов. Затем начинается формирование 4p-подуровня. Порядок заполнения подуровней в соответствии с правилами Клечковского можно записать в виде последовательности: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p. Особенности электронного строения атомов элементов периодической системы Особенности электронного строения атомов элементов в главных и побочных подгруппах, семействах лантаноидов и актиноидов Эффекты экранирования и проникновения За счет экранирования притяжение валентных электронов к ядру ослабевает. Вместе с тем при этом противоположную роль играет проникающая способность к ядру валентных электронов, которая усиливает взаимодействие с ядром. Общий результат притяжения валентных электронов к ядру зависит от относительного вклада в их взаимодействие экранирующего влияния электронов внутренних слоев и проникающей способности валентных электронов к ядру.
Периодический характер свойств элементов, связанных со строениями их электронных оболочек Изменение кислотно-основных свойств оксидов и гидроксидов в периодах и группах Кислотные свойства оксидов элементов усиливаются в периодах слева направо и в группах снизу вверх.! Степени окисления элементов Степень окисления (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов. Представления о степени окисления положены в основу классификации и номенклатуры неорганических соединений. Степень окисления соответствует заряду иона или формальному заряду атома в молекуле или в химической формальной единице, например:
Степень окисления указывается сверху над символом элемента. В отличие от указания заряда атома, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот:
Степень окисления атома в простом веществе равна нулю, например:
Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю:
Понятие степени окисления вполне применимо и для нестехиометрических соединений (КС8, Mo5Si3, Nb3B4 и др.). Например в известной реакции обжига пирита: Суммарная степень окисления атомов в молекуле всегда равна нулю.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 3232; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.219.241 (0.01 с.) |

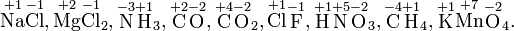
 — степень окисления,
— степень окисления,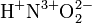 — заряды.
— заряды.





