Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Геометрия простых и сложных молекулСодержание книги
Похожие статьи вашей тематики
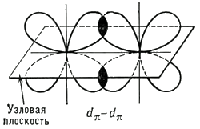
Поиск на нашем сайте Одинарная и кратная свзяь Связи σ и π. Одинарные и кратные связи Два атома между собой могут образовывать и кратные связи, то есть двойные и тройные. При этом составляющая, образующаяся первой, всегда будет σ-связью (обладает наибольшей прочностью и определяет геометрическую форму молекулы). Вторая и третья составляющие называются π-связями, они образуются при боковом перекрывании любых орбиталей, кроме s -орбиталей: Например, 2 p -орбитали двух атомов углерода могут сформировать между собой одинарную, двойную и тройную связи. В первом случае образуется остов молекулы этана C2H6. При двойном связывании атомов углерода первые 2 p -орбитали создают σ-связь, а вторые - π-связь; в этом случае образуется остов молекулы этилена C2H4. При тройном связывании (одна σ-связь, две π-связи) образуется остов молекулы ацетилена C2H2. Такие кратные связи всегда короче и прочнее, чем одинарные, их труднее разорвать. Часто именно этим объясняется химическая инертность веществ - таких, как азот N2 (:N≡N:) и диоксид углерода CO2 (O=C=O). Примеры частиц с кратными связями - это также молекулы SO3, SO2, NO2 и анионы CO32−, SO42−, SO32− Ионная свзяь и ее свойства Образуется за счет полной передачи одного или нескольких электронов между атомами. Атом, отдающий электрон (электроны), становится катионом, а принимающий – анионом. Ионная возникает как результат электростатических сил притяжения между противоположно заряженными ионами. Ионная связь характерна для соединений и элементов, атомы которых имеют большое различие значений электроотрицательности, она возникает между атомами щелочных металлов (электроположительные элементы) и галогенов (электроотрицательные элементы). СВОЙСТВА Структура ионных соединений Структура идеального ионного соединения, обусловленная максимальным притяжением между разноименными ионами и минимальным отталкиванием одноименных ионов, во многом определяется соотношением ионных радиусов катионов и анионов. Это можно показать простыми геометрическими построениями. 51. Донорно – акцепторная связь. Ее свойства, привести примеры Донорно-акцепторный механизм (иначе координационный механизм) — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов, атома-донора и свободной орбитали атома-акцептора. Термины «донорно-акцепторная связь» или «координационная связь» некорректны, поскольку это не есть вид химической связи, а лишь теоретическая модель, описывающая особенность её образования. Свойства ковалентной химической связи, образованной по донорно-акцепторному механизму, ничем не отличаются от свойств связей, образованных по обменному механизму (например, связи N—H в ионе аммония NH4+ или связи O—H в ионе гидроксония Н3O+).
Образование аддукта аммиака итрифторида бора Донорами обычно выступают атомы азота, кислорода, фосфора, серы и др., имеющие неподелённые электронные пары на валентных орбиталях малого размера. Роль акцептора могут выполнять ионизированный атом водорода H+, некоторые p-металлы (напр., алюминий при образовании иона AlH4-) и, в особенности, d-элементы, имеющие незаполненные энергетические ячейки в валентном электронном слое. Именно с позиций донорно-акцепторного механизма описывается образование локализованных ковалентных связей в молекулах и молекулярных ионах комплексных (координационных) соединений: связь формируется за счёт неподелённой пары электронов лиганда и свободной орбитали атома-комплексообразователя. Донорно-акцепторный механизм также описывает образование промежуточных продуктов (интермедиатов) реакции, например, комплексов с переносом заряда. Модель донорно-акцепторного механизма существует только в рамках представлений о валентности как о локализации электронной плотности при образовании ковалентных связей (метод валентных схем). В рамках метода молекулярных орбиталей необходимости в подобных представлениях нет. Водродная связь Это тип межмолекулярных взаимодействий. Эти связи представляют собой слабые постоянно действующие силы между атомом Н, ковалентно связанным с очень электроотрицательным атомом А, и электроотрицательным атомом В, способным предоставить для образования связи свободную пару электронов. Водородную связь обозначают тремя точками. –А-Н…В- Водородные связи образуются только с атомами наиболее электроотрицательных элементов. Наиболее важные из них – F, O, N, Cl. ДОП. 53. Межмолекулярные силы взаимодействия, их свойства (силы Ван-дер-Вальса) Силы Ван-дер-Вальса включают в себя несколько видов взаимодействий: ориентационное диполь-дипольное, индукционное и дисперсионное. 1) Если две молекулы одного и того же вещества или различных веществ представляют собой постоянные диполи, то они притягиваются друг к другу противоположно заряженными краями и соответствующим образом ориентируются в пространстве. ФОРМУЛА (стр. 172). 2) Индукционное взаимодействие заключается в том, что полярная молекула вызывает поляризацию (индуцирует диполь) соседней неполярной молекулы. Далее они ориентируются относительно друг друга в пространстве. В конечном результате наблюдается взаимодействие: диполь – индуцированный диполь. ФОРМУЛА (стр. 172). 3) Дисперсионное взаимодействие - это слабые силы притяжения между нейтральными атомами, например атомами благородных газов, или молекулами, включая неполярные молекулы. ФОРМУЛА (стр. 173).
|
||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1545; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |