Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Геометрическая форма молекул и реакционная способность веществСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Обычно вещества с симметричными молекулами химически более пассивны, чем вещества с асимметричными молекулами. Так, реакционная способность диоксида серы SO2 (незавершенный треугольник) выше, чем у триоксида серы SO3 (правильный треугольник); сульфаты, содержащие симметричный анион SO42− (правильный тетраэдр), химически пассивны по сравнению с сульфитами, содержащими несимметричный ион SO32− (незавершенный тетраэдр). В молекуле NO2 у атома азота N+IV (2 s 12 p 0) на одной из sp 2-гибридных орбиталей находится не электронная пара, а неспаренный электрон. Такие молекулы особенно реакционноспособны, их называют радикалами. В органической химии радикалами являются метил −CH3, этил −C2H5 и многие другие. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ (линейная комбинация атомных орбиталей) ММО ЛКАО Метод Валентных Связей нагляден. Он позволяет теоретически предсказать форму и полярность молекул, валентные углы, виды и свойства реализуемых связей. Однако он не позволяет объяснить устойчивость частиц с нечетным количеством электронов, существование и образование частиц типа Н2+, Не2+ и т.д., не объясняет парамагнитные свойства некоторых молекул, например, кислорода. Эти трудности позволяет в некоторой степени преодолеть Метод Молекулярных Орбиталей. Основные положения метода МО: 1) При образовании молекул все электроны переходят с атомных орбиталей (АО) на молекулярные орбитали (МО). 2) Количество МО равно сумме АО взаимодействующих атомов. Из двух АО образуется две МО, одна из которых обладает меньшей энергией и называется связывающей, другая – большей энергией и называется разрыхляющей. Ψ+= С1 ΨА + С2 ΨВ Ψ-= С3 ΨА – С4 ΨВ , где Ψ+ и Ψ- - волновые функции связывающей и разрыхляющей МО, С – доля участия соответствующих АО в формировании МО. На рисунках показаны схемы образования МО из АО различных типов:
Рис. 14 Схема образования связывающей и разрыхляющей σs МО
Рис. 15 Схема образования молекулы водорода из двух атомов по методу молекулярных орбиталей
Рис. 16 Схема образования связывающей и разрыхляющей σрх МО
Рис. 17 Схема образования связывающей и разрыхляющей πру и πрz МО
Схематично энергетическое распределение молекулярных орбиталей, образованных атомными орбиталями 2-го уровня, следующее:
А В 3) Заполнение МО происходит по принципу наименьшей энергии и правилу Хунда. Энергетический ряд МО: А) при значительном энергетическом различии 2s и 2р орбиталей σ1s св < σ1s разр < σ2s св < σ2s разр < σ2рх св <π2русв =π2рzсв< π2руразр =π2рzразр<σ2рх разр В) при незначительном энергетическом различии 2s и 2р орбиталей σ1s св < σ1s разр < σ2s св < σ2s разр <π2русв =π2р zсв < σ2рх св < π2руразр =π2рzразр<σ2рх разр 4) кратность связи равна полуразности количества связывающих и раэрыхляющих электронов. Образование молекул или заряженных частиц или радикалов возможно при условии, что число электронов на связывающих орбиталях больше, чем на разрыхляющих. 5) молекулы, имеющие неспаренные электроны, обладают парамагнитными свойствами. Рассмотрим распределение электронов на МО молекулы кислорода:
Электронный паспорт молекулы кислорода запишется так: (σ1s св )2(σ1s разр)2(σ2s св)2(σ2s разр)2(σ2рх св)2(π2русв)2(π2рzсв)2(π2руразр)1 (π2рzразр)1(σ2рх разр)0 Кратность связи равна двум, имеется два неспаренных электрона, объясняющие парамагнитные свойства кислорода.
Электронный паспорт молекулы фтора: (σ1s св )2(σ1s разр)2(σ2s св)2(σ2s разр)2(σ2рх св)2(π2русв)2(π2рzсв)2(π2руразр)2 (π2рzразр)2(σ2рх разр)0 Кратность связи равна единице, все электроны спарены, что объясняет диамагнитные свойства фтора.
Распределение электронов на МО молекулы фтора. Ионная связь. Свойства ионной связи. Электроны в ионных соединениях в высшей степени локализованы, т.е. принадлежат одному из атомов. В отличие от ковалентной связи ионная связь ненаправлена, так как силовое поле ионов равномерно распределяется во всех направлениях. Ионная связь теоретически ненасыщаема, так как энергетически выгодно, когда каждый ион окружен максимальным числом ионов противоположного знака. Однако из-за отталкивания одноименных ионов устойчивость системы достигается лишь при определенной взаимной координации ионов, характеризуемой координационным числом. При нормальных условиях ионные соединения представляют собою кристаллические вещества. В узлах кристаллической решетки ионных соединений в определенной последовательности чередуются катионы и анионы. Каждый катион оказывается окруженным определенным количеством анионов и наоборот.
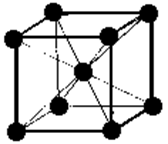
Рис. 18 Структура кристаллов NaCl и CsCl
Рис. 19 Взаимная координация ионов в кристаллах NaCl (а) и CsCl (б) Следует заметить, однако, что вследствие волновой природы электрона полное разделение зарядов невозможно. Поэтому даже в таком ионном соединении, как СsF, доля ионной связи составляет 96%. Большую роль играет и поляризация ионов, благодаря чему связь становится менее полярной. При стандартных условиях соединения с ионными связями существуют в виде твердых кристаллических тел. В ионных кристаллах нет отдельных молекул. В растворах ионных соединений нет молекул. При растворении в полярных растворителях (вода, спирты и т.п.) ионные соединения полностью диссоциируют, а в неполярных (СС l 4, С6Н6 и т.п.) – они обычно нерастворимы. Ионные молекулы можно обнаружить только в парах ионных соединений, при этом помимо молекул в парах обнаруживаются различные частицы – ассоциаты из нескольких молекул, а также простые и сложные ионы. Например, в парах хлорида натрия кроме молекул NаС l присутствуют такие частицы: (NаС l)2, (NаС l)3, Nа2С l +, NаС l2 –. Соединения с ионными кристаллическими решетками имеют высокие температуры плавления и кипения. Многие ионные кристаллы относятся к классу диэлектриков. При стандартных условиях их электропроводность на десятки порядков ниже, чем у металлов. С ростом температуры наблюдается увеличение электропроводности. Металлическая связь. Некоторые свойства металлов, такие, например, как высокая тепло- и электропроводность, ковкость, способность образовывать кристаллические решетки с высокими координационными числами (8, 12) дают основание заключить, что электроны в металле не связаны с какими-либо конкретными атомами, а перемещаются по всей конденсированной фазе достаточно свободно, что обусловливает их высокие тепло- и электропроводность. Наличие делокализованных электронов связано с ненаправленным характером химических связей, поэтому атомы металлов легко перемещаются из одного равновесного положения в другое, что обусловливает ковкость этих веществ. В металлах, очевидно, небольшое число электронов одновременно связывает большое число ядер.
Таким образом, химическая связь в металлах не локализована и не направлена. Металл можно рассматривать как плотно упакованную структуру из катионов, связанных друг с другом «электронным газом».
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 474; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.174.45 (0.009 с.) |