
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярно-кінетична теорія ідеального газуСодержание книги
Поиск на нашем сайте
Основні формули 1. Рівняння стану ідеального газу або рівняння Клапейрона
де p – тиск газу; V – його об'єм; T – абсолютнатемпература; m – маса газу; m – маса одного моля газу; R =8,31 Дж /(моль.К) – газова стала; m/m – число молів.
2. Кількість речовини газу (у молях)
де N – число молекул газу; NA = 6,02.10 23 моль-1 – постійна Авогадро.
3. Кількість речовини в суміші газів визначається
n = n1+n2+...+nn = N1/NA + N2/NA +... + Nn/NA
або n = m1/m1 + m2/m2 +... + mn/mn,
де ni, Ni, mi, mi – відповідно кількість речовини, число молекул, маса, молярна маса i -ї компоненти суміші.
4. Молярна маса суміші газів
де mi – маса i -ї компоненти суміші; ni – кількість речовини i -ї компоненти суміші; n – число компонент суміші. Масова частка wi i -ї компоненти суміші газів (у долях одиниці)
де m – маса суміші.
5. Концентрація молекул
де N – число молекул, що втримуються в даній системі;
V – об'єм системи. Формула справедлива не тільки для газів, але й для будь-якого агрегатного стану речовини.
6. Тиск суміші газів (закон Дальтона) дорівнює сумі їх парціальних тисків
де n – число компонент суміші. Парціальним тиском називається тиск газу, який мав би кожен газ, що входить до складу суміші, за умови, що при даній температурі він один заповнював би весь об'єм.
7. Основне рівняння молекулярно-кінетичної теорії газів
де n – число молекул в одиниці об'єму; <en> – середня енергія поступального руху однієї молекули; m – маса молекули; <
8. Середня кінетична енергія поступального руху молекули
де k = R/Na = 1,38 . 10-23 Дж/К – стала Больцмана.
9. Середня повна кінетична енергія молекули
де i – число ступенів вільності молекули. Для одноатомного газу i = 3; для двохатомного газу i = 5; для багатоатомного газу i = 6.
10. Залежність тиску газу від концентрації молекул і температури
11. Швидкості газових молекул: - середня квадратична швидкість
- середня арифметична швидкість
- найбільш імовірна швидкість
де m – маса однієї молекули.
12. Відносна швидкість молекули
де
13. Закон розподілу молекул за швидкостями (закон Максвелла) дозволяє знайти число молекул dN, відносні швидкості яких лежать в інтервалі від u до u+ du,
де du – величина інтервалу відносних швидкостей мала в порівнянні зі швидкістю u; N – загальне число молекул в системі. Щоб визначити, яка частина молекул DN/N має відносні швидкості в діапазоні від u1 до u2, треба розрахувати такий вираз
14. Класичний розподіл Максвелла буде мати інший вигляд, якщо відносну швидкість виразити через значення середньої і найбільш імовірної швидкостей
звідки
Після підстановки цих значень у формулу розподілу Максвелла через відносні швидкості одержуємо цей же розподіл в іншому вигляді
15. Розподіл Больцмана (розподіл частинок у силовому потенціальному полі Un
де n – концентрація частинок в тих точках силового поля, де потенціальна енергія Un; n0 – концентрація частинок у тих точках силового поля, де Wn=0.
16. Середня довжина < l > вільного пробігу молекул газу
де d – ефективний діаметр молекул; n – концентрація молекул газу.
17. Середнє число зіткнень молекул за одиницю часу
де
d – ефективний діаметр молекули; n – концентрація молекул газу. 18. Динамічна в’язкість газового середовища
η =
де ρ – густина газу (рідини); < l > – середня довжина вільного пробігу молекул. 19. Закон Ньютона F =
де η – коефіцієнт динамічної в’язкості;
ΔS – площадка переносу газу. 20. Закон Фурє
де χ =
ΔS – площадка переносу газу; Δt – час переносу теплової енергії; сυ – теплоємність газу при сталому об’ємі. 21. Закон Фіка
де – D =
m – маса однієї молекули газу. Приклади розв’язання задач Приклад 1. Визначити число молекул, які містяться в об'ємі 1 мм3 води, і масу молекули води. Знайти також діаметр молекул. Вважати умовно, що молекули води мають вигляд кульок, які щільно прилягають одна до одної.
Дано: H2O V= 1 мм3 = 10-9м3 ______________ N –? m1 –? d –? Розв’язування. Число N молекул, які втримуються в деякій системі масою m, дорівнює добутку постійної Авогадро NA на кількість речовини n
Оскільки n = m/m, де m – молярна маса, то N = (m / m) NA. Виразивши в цій формулі масу як добуток густини на об'єм V, одержимо
Виконаємо обчислення, врахувавши, що m = 18 . 10-3 кг/моль, r = 1,0.103 кг/м3
Масу m1 однієї молекули можна знайти за формулою
Підставивши в (2) значення m і NA, знайдемо масу молекули води
Якщо молекули води щільно прилягають одна до одної, то можна вважати, що на кожну молекулу приходиться об'єм V1 = d3, де d – діаметр молекули. Звідки
Об'єм V1 знайдемо, розділивши об'єм моля
Підставивши вираз (4) в (3), одержимо
де V
Тоді
Зробимо необхідні розрахунки
Приклад 2. Знайти масу сірчистого газу (SO2), який займає об'єм 25 л при температурі 27о С і тиску 101 кПа. Дано: SO2 V = 25 л = 25.10-3 м3 t = 27оC P = 101 кПа = 1,01.105 Па ___________________ m –?
Розв’язування. З рівняння Клапейрона маса газу дорівнює
Визначаємо молярну масу сірчистого газу за даними таблиці Менделєєва Обчислюємо масу
Приклад 3. Балон містить 80 г кисню й 300 г аргону. Тиск суміші 10 атм, температура 15оС. Приймаючи дані гази за ідеальні, визначити ємність балона. Дано: O2 m1 = 80 г = 8.10-2 кг Аr m2 = 300 г = 3.10-1 кг t = 15о C P = 10 атм = 1,01.106 Па _____________________ V –?
Розв’язування. За законом Дальтона тиск суміші дорівнює сумі парціальних тисків газів, що входять до складу суміші. Парціальним тиском газу називається тиск, який здійснював би газ, якби тільки він один перебував у посудині, зайнятій сумішшю. З рівняння Клапейрона парціальні тиски кисню p1 й аргону p2 виражаються формулами
Отже, за законом Дальтона для суміші газів p = p1 + p2 або
звідки об’єм балона дорівнює
Виразимо в одиницях СІ числові значення величин, які входять у цю формулу: m1 = 0,08 кг; m1 = 32.10-3 кг/моль; m2 = 0,3 кг; m2 = 40.10 -3 кг/моль; p = 10.1,01. 105 Па; T = 288K; R = 8,31 Дж /(моль . К). Підставимо числові значення у формулу (1) і виконаємо необхідні розрахунки
Приклад 4. Знайти кінетичну енергію обертального руху однієї молекули кисню при температурі 130С, а також кінетичну енергію обертального руху всіх молекул, які містяться в 4 г кисню. Дано: O2 m = 4 г = 4.10-3 кг t = 13оC _____________ eоб –? Wоб –? Розв’язування. Відомо, що на кожну ступінь вільності молекули газу доводиться однакова енергія, яка виражається формулою
де k – стала Больцмана; T – абсолютна температура газу. Оскільки обертальному руху двохатомної молекули (молекула кисню – двохатомна) приписуються дві ступені вільності, то енергія обертального руху молекули кисню виразиться формулою
Підставивши у формулу (2) k = 1,38 . 10-23 Дж/К й T =286 K, одержимо
Кінетична енергія обертального руху всіх молекул газу визначається з рівності
де N – число всіх молекул газу. Число молекул N можна одержати за формулою
де NA – число Авогадро; n – число молів газу. Число молів газу дорівнює
де m – маса газу;
Кількість молекул газу визначається із формули (4)
Підставивши цей вираз N у рівність (3), одержимо
Виразимо величини, що входять у цю формулу, в одиницях СІ:
Підставивши ці значення у формулу (6), знайдемо
Приклад 5. На якій висоті над рівнем моря густина повітря зменшується у 2 рази? Вважати, що температура повітря не залежить від висоти й дорівнює 0оС. Молярна маса повітря дорівнює 29.10-3 кг/моль. Дано: r1/ r2 = 2 t = 0оC __________ h –? Розв’язування. Густина ідеального газу (і його концентрація n) зв'язані співвідношенням r = nm0, де m0 = m / NA – маса однієї молекули повітря; m – молярна маса повітря; NA – число Авогадро. Таким чином, відношення густин газу r1/r2 дорівнює відношенню концентрацій молекул n1/n2. Відповідно до розподілу Больцмана концентрація n молекул повітря на висоті h дорівнює
де n0 – концентрація молекул на рівні моря (h = 0); Un – потенціальна енергія молекули на висоті h визначається за формулою Un = m0gh (якщо h = 0 то Un= 0). Концентрації молекул на висоті h = 0 і h відповідно дорівнюють
n1 = n0 й n2 = n0 e
Відношення концентрацій на цих висотах дорівнює
де NAk = R і NAm 0 =
Беремо натуральний логарифм від обох частин відношення й знаходимо висоту h
Підставивши в отриману формулу дані з умови задачі, одержимо
h = ЕЛЕМЕНТИ ТЕРМОДИНАМІКИ Основні формули 1. Перший принцип термодинаміки
Q =
де Q – теплота, передана системі;
A – робота, виконана системою проти зовнішніх сил. 2. Зв'язок між питомою c і молярною Cm теплоємностями
Cm = cm.
3. Питома теплоємність газу при постійному об'ємі
4. Питома теплоємність газу при постійному тиску
5. Внутрішня енергія газу (енергія теплового руху молекул)
6. Робота розширення газу від об'єму V1 до об'єму V2 дорівнює
7. Робота газу в різних процесах визначають так: – при ізотермічному процесі
A = (m / m) RT ln(V2 /V1 );
– при ізобарному процесі
A = p (V2 - V1 );
– при адіабатному процесі
де g = cp / cv – показник адіабати. 8. Рівняння Пуассона, яке пов'язує параметри ідеального газу при адіабатному процесі
p g = const або TV g-1 = const.
9. Коефіцієнт корисної дії теплової (ККД) машини
де Q1 – тепло, передане робочому тілу; Q2 – тепло, передане холодильнику.
10. Термічний ККД циклу Карно
де T1 – температура нагрівача; T2 – температура холодильника.
11. Збільшення ентропії при переході із стану A у стан В
яка складається із приростів ентропії у проміжних процесах
Приклади розв’язання задач
Приклад 1. Чому дорівнюють питомі теплоємності cv і сp деякого двохатомного газу, якщо густина цього газу при нормальних умовах дорівнює 1,43 кг/м3? Дано: r = 1,43 кг/м3 i = 5 ____________ cp –? cv –? Розв’язування. Питомі теплоємності газів при сталому об’ємі і сталому тиску відповідно дорівнюють
З рівняння Клапейрона знаходимо молярну масу
оскільки густина газу Підставляючи молярну масу у формули для теплоємності, одержуємо:
Виконаємо розрахунки, врахувавши, що для двохатомного газу число ступенів вільності i = 5. Тиск газу і температура при нормальних умовах відповідно дорівнюють p = 1,01.105 Па й T = 2730 K, тому:
Приклад 2. Кисень масою 2 кг займає об'єм 1 м3 і перебуває під тиском 0,2 МПа. Газ був нагрітий спочатку при постійному тиску до об'єму 3 м3, а потім при постійному об'ємі до тиску 0,5 МПа. Знайти зміну внутрішньої енергії газу, виконану ним роботу й теплоту, передану газу. Побудувати графік процесу. Дано: О2 m = 2 кг V1 = 1 м3 p1 = 0,2 МПа = 2.105 Па 1) p = const, V2 = 3 м3 2) V = const, p3 = 0,5 МПа = 5.105 Па DU –? A –? Q –? Розв’язування. Зміна внутрішньої енергії газу
де i – число ступенів вільності молекул газу (для двохатомних молекул кисню i = 5); DT = T3 - T1 – різниця температур газу в кінцевому (третьому) і початковому станах. Початкову й кінцеву температуру газу знайдемо з рівняння Клапейрона
звідки
Робота розширення газу при постійному тиску виражається формулою
A1 =
Робота газу, який нагрівається при постійному об'ємі, дорівнює нулю
A2 = 0. Отже, повна робота, виконана газом дорівнює,
A = A1 + A2 = A1.
Відповідно до першого принципу термодинаміки теплота Q1, передана газу, дорівнює сумі зміни внутрішньої енергії DU і роботи A
Q = DU + A.
Виконаємо обчислення, урахувавши, що для кисню m = 32 .10-3 кг/моль:
A = A1 = 0,4 МДж;
Q = (3,24 + 0,4) МДж = 3,64 МДж.
Графік процесу наведений на рис 2.
Рисунок 2 Приклад 3. У циліндрі під поршнем перебуває водень масою 0,02 кг при температурі 300К. Водень спочатку розширився адіабатно, збільшивши свій об'єм в 5 разів, а потім був стиснутий ізотермічно, причому об'єм газу зменшився в 5 разів. Знайти температуру наприкінці адіабатного розширення й роботу, виконану газом при цих процесах. Зобразити процес графічно. Дано: H2 m = 0,02 кг T1 = 300 K 1) DQ = 0 V2/V1 = 5 2) DT = 0 V3/V2 = 1/5 ________________ T3 –? A2 –? A3 –?
Розв’язування. Температури й об'єми газу, що виконує адіабатичний процес, зв'язані між собою співвідношенням
де g – відношення теплоємностей газу при постійному тиску й постійному об'ємі; n1 = V2/V1 – відношення об’ємів газу в процесі.
Рисунок 3
Звідси одержуємо такий вираз для кінцевої температури
T2 = T1 / n1g -1. Робота A1 газу при адіабатичному розширенні може бути визначена за формулою
де сV – питома теплоємність газу при постійному об'ємі. Робота A2 газу при ізотермічному процесі може бути виражена у вигляді
де n2 = V2/V3. Виконаємо необхідні обчислення урахувавши, що для водню як двохатомного газу g = 1,4, i = 5 й m = 2 . 10-3 кг/моль
Оскільки 50,4 = 1,90 (знаходиться логарифмуванням), то
Знак мінус показує, що при стисненні робота газу виконується проти зовнішніх сил. Графік процесу зображений на рис. 3. Приклад 4. Теплова машина працює за зворотним циклом Карно (рис. 4). Температура нагрівача 500K. Визначити термічний ККД циклу й температуру холодильника теплової машини, якщо за рахунок кожного кілоджоуля теплоти, отриманої від нагрівача, машина виконує корисну роботу в 350 Дж. Втрати теплової енергії на тертя не враховувати. Дано: T1 = 500K Q1 = 1кДж .= 103 Дж Aк = 350 Дж _______________ h –? T2 –?
Рисунок 4 Розв’язування. Термічний ККД теплової машини показує, яка частина теплової енергії отримана від нагрівача, перетворюється в механічну роботу. Термічний коефіцієнт корисної дії виражається формулою
h = A / Q1,
де Q1 – теплота, отримана від нагрівача; А – робота, виконана робочим тілом теплової машини. Знаючи ККД циклу, можна за формулою h = (T1 - T2) / T1 визначити температуру холодильника T2
T2 = T1 (1 - h).
Виконаємо необхідні розрахунки:
T2 = 500 (1 - 0,35) K = 325 K.
Приклад 5. Знайти зміну ентропії при перетворенні 10 г льоду взятого при температурі -20о С у пару при температурі 100о С. Дано: m = 10 г = 10-2кг t1 = -20о C t2 = 100о C ____________
Розв’язування. Зміна ентропії визначається за допомогою формули
де S1 і S2 – значення ентропії відповідно в першому й у другому стані. У цьому випадку загальна зміна ентропії 1. Нагрівання маси m льоду від температури T1 до температури T2
dQ = mc1 dT,
де c1 – питома теплоємність льоду. Таким чином, зміна ентропії в цьому процесі відповідно до формули (1) дорівнює
DS1 = mc1
2. Плавлення маси m льоду при температурі T2. Тут
де
3. Нагрівання маси m води від T2 до T3. Аналогічно за формулою (2), одержуємо
D S3 = mc2 ln(T3 / T2),
де с2 – питома теплоємність води. 4. Випаровування маси m води при температурі T3. Тут зміна ентропії буде дорівнювати
де r – питома теплота паротворення. Загальна зміна ентропії дорівнює (закон зростання ентропії)
DS = DS1 + DS2 + DS3 + DS4 = m [c1 ln(T2 / T1) + l/T2 + c2 ln(T3/T2) + r/T3]. Виконавши необхідні обчислення, маючи на увазі, що c1=2,1.103 Дж / кг.К, T1 = 253K, T2 = 273K, T3 = 373K, l = 3,35.105 Дж / кг, с2 = 4,19.103 Дж / (кг.К), r = 2,26.106 Дж / кг, одержимо
Приклад 6. Знайти зміну ентропії при переході 8 г кисню від об'єму в 10 л при температурі 80о С до об'єму в 40 л при температурі 300о С. Дано: m = 8 м = 8.10-3кг V1 = 10 л = 10-2м3 t1 = 80о C V2 = 40 л = 4.10-2м3 t2 = 300о C _______________
Розв’язування. Зміну ентропії для будь-якого процесу знаходять за формулою
Але
де З урахуванням рівняння Клапейрона
маємо або
Виконавши необхідні розрахунки одержуємо Задачі 798. У балоні знаходиться m1 = 8 г водню і m2 = 12 г азоту при температурі t = 17о С і тиску p = 1,8·105 Па. Визначити молярну масу μ суміші й об’єм V балона. Відповідь: μ = 4,51.10-3 кг/моль; V=0,06 м3.
799. Знайти тиск р суміші газу в посудині об’мом V = 5 л, якщо в ньому знаходиться N1 = 2·1015 молекул кисню, N2 = 8·1015 молекул азоту і m = 1,0 нкг аргону. Температура суміші t = 17оС. Відповідь: р = 19,7.10-3 Па.
800. Один балон об’ємом 10 л містить кисень під тиском 1,5 МПа, інший балон об’ємом 22 л містить азот під тиском 0,6 МПа. Обидва балони були з'єднані між собою, і обидва гази змішалися, утворивши однорідну суміш (без зміни температури). Знайти парціальний тиск обох газів у суміші і повний тиск суміші. Відповідь: pn1 = 0,47.106 Па; pn2 = 0,41.106 Па; p = 0,88.106 Па.
801. У посудині А об’ємом V1 = 2 л знаходиться газ під тиском p1 = 2·105 Па, а в посудині В об’ємом V2 = 4 л знаходиться той же газ під тиском p2 = 1·105 Па. Температура в обох посудинах однакова і постійна. Під яким тиском р буде знаходитися газ після з’єднання посудин А и В трубкою? Знайти парціальні тиски газів у суміші. Об’ємом з’єднувальної трубки знехтувати. Відповідь: pn1 = 0,66.105 Па; pn2 = 0,66.105 Па; p = 1,33.105 Па.
802. У балоні об’ємом 22,4 л знаходиться водень при нормальних умовах. Після того, як у балон була додатково введена деяка кількість гелію, тиск у балоні зріс до 0,25 МПа, а температура не змінилася. Визначити масу гелію, введену додатково в балон. Відповідь: m = 6.10-3 кг.
803. У балоні знаходиться 10 кг деякого газу під тиском 107 Па. Яку кількість газу взяли з балона, якщо остаточний тиск в балоні знизився до 2,5·106 Па? Температуру газу вважати постійною. Відповідь: Δm = 7,5кг. 804. Суміш водню й азоту загальною масою 290 г при температурі 600 К і тиску 2,46 МПа займає об’єм 30 л. Визначити масу водню і масу азоту в суміші. Відповідь: m1 = 9,5 г (Н2); m2 = 280,5 г (N2).
805. Два балони однакового об’єму містять кисень. В одному балоні тиск p1 = 2 МПа і температура T1 = 800 К, в іншому p2 = 2,5 МПа і T2 = 200 К. Балони з'єднали трубкою й охолодили кисень в них до температури Т = 200 К. Який тиск установиться в балонах? Відповідь: p = 1,5 MПа.
806. У посудині знаходиться суміш кисню і водню. Маса суміші дорівнює 3,6 кг. Масова частка кисню складає 0,6. Визначити маси кожного газу в посудині. Відповідь: m1 = 2,16кг (О2); m = 1,44 кг (Н2).
807. У колбі ємністю 100 см³ утримується деякий газ при температурі 300 К. На скільки знизиться тиск газу в колбі, якщо внаслідок витоку з колби вийде 1020 молекул цього газу? Відповідь:
808. Знайти середню кінетичну енергію обертального руху однієї молекули кисню при температурі Т = 350 К, а також кінетичну енергію Е обертального руху всіх молекул кисню масою m = 4 г. Відповідь: ξср. = 4,83.10-21 Дж; ξ об. = 363 Дж.
809. Визначити сумарну кінетичну енергію Е поступального руху всіх молекул газу, які знаходиться в посудині об’ємом V = 3 л під тиском р = 540 кПа. Відповідь: ξ = 2,43 кДж.
810. Визначити середню кінетичну енергію однієї молекули водяної пари при температурі Т = 500 К. Відповідь: ξср . = 2,07.10-20 Дж.
811. Визначити середню квадратичну швидкість Відповідь: υкв . = 2.103 м/с.
812. Скільки молекул газу міститься у балоні місткістю V = 30 л при температурі Т = 300 К и тиску р = 5 МПА? Відповідь: N = 3,6.1025. 813. Визначити середнє значення повної кінетичної енергії однієї молекули гелію, кисню і водяної пари при температурі Т = 400 К. Відповідь: ξcр.1= 8,28.10-21 Дж; ξср.2= 1,38.10-20 Дж; ξср.3=1,65.10-20 Дж.
814. Знайти середню кінетичну енергію обертального руху всіх молекул, які містяться в 0,20 г водню при температурі 27оС. Відповідь: ξср . = 249 Дж.
815. Тиск ідеального газу 10 мПа, концентрація молекул 8·1010 см-3. Визначити середню кінетичну енергію поступального руху однієї молекули і температуру газу. Відповідь: ξср. = 1,87.10-19 Дж.
816. Визначити середнє значення повної кінетичної енергії однієї молекули аргону і водяної пари при температурі 500 К. Відповідь: ξср.1 = 1,035.10-20 Дж; ξср.2 = 2,07.10-20 Дж.
817. У посудині, яка має форму кулі, радіус якої 0,1 м, знаходиться 56 г азоту. До якої температури можна нагріти посудину, якщо її стінки витримують тиск 15·106 Па? Відповідь: Т = 3778 К.
818. Знайти відносне число молекул ΔN/N гелію, швидкості яких відрізняються від найбільш імовірної швидкості не більше ніж на 10 м/с, при температурах газу: а) T1 = 300 К, б) T2 = 600 К. Відповідь: ΔN/N = 0,0074 ( для Т1); ΔN/N = 0,0052 (для Т2).
819. Обчислити середню квадратичну швидкість Відповідь: υкв. = 517 м/с; ΔN/N = 0,017.
820. Обчислити середню арифметичну швидкість Відповідь: ΔN/N = 0,020.
821. Азот займає об’єм V = 2,5 л при тиску р = 20 Па і температурі Т = 300 К. Яке число молекул азоту має швидкості, що відрізняються від найбільш ймовірної не більш ніж на 0,01%. Відповідь: ΔN = 9,47.1014.
822. При якій температурі Т найбільш імовірна швидкість молекул азоту менша їх середньої квадратичної швидкості на 50 м/с? Відповідь: Т = 82,26 К.
823. Знайти відносне число молекул Відповідь:
824. Тиск повітря біля поверхні Землі р = 100 кПа. Вважаючи температуру повітря постійною і рівною Т = 270 К визначити концентра-цію молекул n повітря: а) біля поверхні Землі; б) на висоті h = 8 км. Молярна маса повітря Відповідь: n = 9,73.1024 1/м3.
825. На якій висоті h тиск пові
|
||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 195; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.119.191 (0.011 с.) |



 або
або 
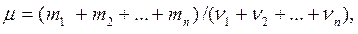
 ,
, 

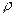 – густина речовин;
– густина речовин;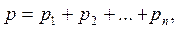

 2> – середнє значення квадрата швидкості.
2> – середнє значення квадрата швидкості.
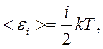

 ;
; ;
;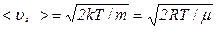 ,
, ,
, – найбільш імовірна швидкість.
– найбільш імовірна швидкість. .
. .
. ,
, а також
а також  і
і 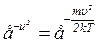 .
. .
.
 ,
,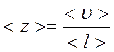 =
= 
 – середня швидкість газових молекул;
– середня швидкість газових молекул; – довжина вільного пробігу молекул;
– довжина вільного пробігу молекул; ,
,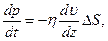
 – градієнт швидкості газу;
– градієнт швидкості газу;
 – коефіцієнт теплопровідності газу;
– коефіцієнт теплопровідності газу; – градієнт температури;
– градієнт температури;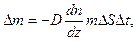
 – коефіцієнт дифузії газу;
– коефіцієнт дифузії газу; – градієнт концентрації газу;
– градієнт концентрації газу;
 (1)
(1)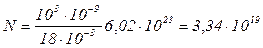 молекул.
молекул. (2)
(2)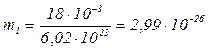 кг.
кг. (3)
(3) на число молекул у молі, тобто на NА
на число молекул у молі, тобто на NА (4)
(4) ,
,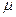 = m / r.
= m / r. . (5)
. (5)
 .
. й абсолютна температура T = t + 273о = 27о + 273о = 300о K.
й абсолютна температура T = t + 273о = 27о + 273о = 300о K.
 і
і 

 (1)
(1)
 (1)
(1) (2)
(2) Дж.
Дж. , (3)
, (3) (4)
(4)
 (5)
(5) (6)
(6) моль-1;
моль-1;  кг;
кг;  кг/моль;
кг/моль; Дж.
Дж.
 ,
,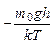 .
. ,
,
 = 5,5.10 3м.
= 5,5.10 3м. U + A,
U + A,

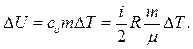

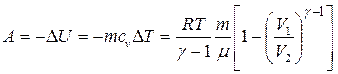 ,
,

 ,
, .
. і
і 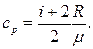

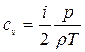 і
і 
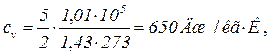

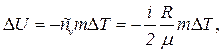 (1)
(1)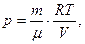
 .
. .
.


 Дж = 0,4 . 106 Дж = 0,4 МДж;
Дж = 0,4 . 106 Дж = 0,4 МДж;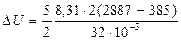 Дж = 3,24 . 106 Дж = 3,24 МДж;
Дж = 3,24 . 106 Дж = 3,24 МДж;
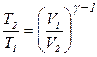 або
або 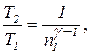


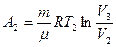 або
або 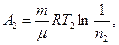






 = 350 / 1000 = 0,35;
= 350 / 1000 = 0,35; (1)
(1)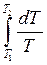 = mc1 ln(T2 / T1). (2)
= mc1 ln(T2 / T1). (2) , (3)
, (3) – питома теплота плавлення.
– питома теплота плавлення.

 ,
, – теплоємність кисню при сталому об’ємі.
– теплоємність кисню при сталому об’ємі. ,
,
 .
.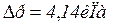 .
.



