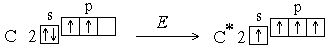Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристики ковалентной связиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Важными количественными характеристиками ковалентной связи являются энергия связи, ее длина и дипольный момент. Энергия связи – энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов. Энергия связи характеризует ее прочность.
Длина связи – расстояние между центрами связанных атомов. Чем меньше длина, тем прочнее химическая связь.
Дипольный момент связи (μ) – векторная величина, характеризующая полярность связи (измеряется в дебаях D или кулон-метрах: 1 D = 3,4·10-30 Кл·м). Длина вектора равна произведению длины связи l на эффективный заряд q, который приобретают атомы при смещении электронной плотности: | μ | = l · q. Вектор дипольного момента направлен от положительного заряда к отрицательному. При векторном сложении дипольных моментов всех связей получают дипольный момент молекулы.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой. Термин ковалентная связь был впервые введён лауреатом Нобелевской премии Ирвингом Ленгмюром в 1919 году[1][2]. Этот термин относился к химической связи, обусловленной совместным обладанием электронами, в отличие от металлической связи, в которой электроны были свободными, или от ионной связи, в которой один из атомов отдавал электрон и становилсякатионом, а другой атом принимал электрон и становился анионом. Позднее (1927 год) Ф.Лондон и В.Гайтлер на примере молекулы водорода дали первое описание ковалентной связи с точки зрения квантовой механики. С учётом статистической интерпретации волновой функции М.Борна плотность вероятности нахождения связывающих электронов концентрируется в пространстве между ядрами молекулы (рис.1). В теории отталкивания электронных пар рассматриваются геометрические размеры этих пар. Так, для элементов каждого периода существует некоторый средний радиус электронной пары (Å): 0,6 для элементов вплоть до неона; 0,75 для элементов вплоть до аргона; 0,75 для элементов вплоть до криптона и 0,8 для элементов вплоть до ксенона.[3] Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений. Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными. Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей. Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (H2, Cl2, N2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы). Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам. Электроны тем подвижнее, чем дальше они находятся от ядер. Однако, дважды лауреат Нобелевской премии Л. Полинг указывал, что «в некоторых молекулах имеются ковалентные связи, обусловленные одним или тремя электронами вместо общей пары»[2]. Одноэлектронная химическая связь реализуется в молекулярном ионе водорода H2+. Молекулярный ион водорода H2+ содержит два протона и один электрон. Единственный электрон молекулярной системы компенсирует электростатическое отталкивание двух протонов и удерживает их на расстоянии 1,06 Å (длина химической связи H2+). Центр электронной плотности электронного облака молекулярной системы равноудалён от обоих протонов на боровский радиус α0=0,53 Å и является центром симметрии молекулярного иона водорода H2+. 9- вопрос) Способы образования ковалентной связи. Приведите примеры. Способы образования ковалентной связи Существуют два главных способа образования ковалентной связи *. 1) Электронная пара, образующая связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденныхатомах. Однако число ковалентных связей может быть больше числа неспаренных электронов. Например, в невозбужденном состоянии (которое называется также основным состоянием) атом углерода имеет два неспаренных электрона, однако для него характерны соединения, в которых он образует четыре ковалентные связи. Это оказывается возможным в результате возбуждения атома. При этом один из s-электронов переходит на p-подуровень:
Увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на возбуждение атома. Поскольку валентность атома зависит от числа неспаренных электронов, возбуждение приводит к повышению валентности. У атомов азота, кислорода, фтора количество неспаренных электронов не увеличивается, т.к. в пределах второго уровня нет свободных орбиталей *, а перемещение электронов на третий квантовый уровень требует значительно большей энергии, чем та, которая выделилась бы при образовании дополнительных связей. Таким образом, при возбуждении атома переходы электронов на свободныеорбитали возможны только в пределах одного энергетического уровня. Элементы 3-го периода – фосфор, сера, хлор – могут проявлять валентность, равную номеру группы. Это достигается возбуждением атомов с переходом 3s- и 3p-электронов на вакантные орбитали 3d-подуровня: P* 1s22s22p6 3s13p33d1 (валентность 5) S* 1s22s22p6 3s13p33d2 (валентность 6) Cl* 1s22s22p6 3s13p33d3 (валентность 7) В приведенных выше электронных формулах * возбужденных атомов подчеркнуты подуровни *, содержащие только неспаренныеэлектроны. На примере атома хлора легко показать, что валентность может быть переменной:
В отличие от хлора, валентность атома F постоянна и равна 1, т.к. на валентном (втором) энергетическом уровне отсутствуюторбитали d-подуровня и другие вакантные орбитали. 2) Ковалентные связи могут образовываться за счет спаренных электронов, имеющихся на внешнем электронном слое атома. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Например, образование иона аммония из молекулы аммиакаи иона водорода можно отобразить схемой:
Атом, предоставляющий свою электронную пару для образования ковалентной связи *, называется донором, а атом, предоставляющий пустую орбиталь, – акцептором. Ковалентная связь, образованная таким способом, называется донорно-акцепторной связью. В катионе аммония эта связь по своим свойствам абсолютно идентична трем другим ковалентным связям, образованным первым способом, поэтому термин “донорно-акцепторная” обозначает не какой-то особый вид связи, а лишь способ ее образования.
10-вопрос) Кислотно-основное взаимодействие – реакции нейтрализации. Кислые и основные соли. Приведите примеры. NaOH + HCl = NaCl + H2O - реакция нейтрализации Теории кислот и оснований — совокупность фундаментальных физико-химических представлений, описывающих природу и свойства кислот и оснований. Все они вводят определения кислот и оснований — двух классов веществ, реагирующих между собой. Задача теории — предсказание продуктов реакции между кислотой и основанием и возможности её протекания, для чего используются количественные характеристики силы кислоты и основания. Различия между теориями лежат в определениями кислот и оснований, характеристики их силы и, как следствие — в правилах предсказания продуктов реакции между ними. Все они имеют свою область применимости, каковые области частично пересекаются. Кислотно-основные взаимодействия чрезвычайно распространенены в природе и находят широкое применение в научной и производственной практике. Теоретические представления о кислотах и основаниях имеют важное значение в формировании всех концептуальных систем химии и оказывают разностороннее влияние на развитие многих теоретических концепций во всех основных химических дисциплинах. На основе современной теории кислот и оснований разработаны такие разделы химических наук, как химия водных и неводных растворов электролитов, рН-метрия в неводных средах, гомо- и гетерогенный кислотно-основный катализ, теория функций кислотности и многие другие.
11- вопрос) Ионная связь, ее свойства, приведите примеры. В отличие от ковалентной связи ионная связь не обладает насыщаемостью.
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Рассмотрим способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 Зs2 3р5. Это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. — l е —> Na+ ион натрия, устойчивая восьми электронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня.:Cl + 1е -->.Cl - ион хлора, устойчивая восьми электронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы. Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу), то общая электронная параполностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Вернее, такой взгляд удобен. На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов. Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы окружённые диполями растворителя. При растворении подобных соединений, как правило, выделяется энергия, так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион. Исключения составляют многие соли азотной кислоты (нитраты), которые при растворении поглощают тепло (растворы охлаждаются). Последний факт объясняется на основе законов, которые рассматриваются в физической химии.
примеры: (MgS, K2CO3), основания(LiOH, Ca(OH)2), основные оксиды(BaO, Na2O)
12) Обменные реакции в растворах. Приведите примеры. В практически необратимых реакциях равновесие сильно смещено в сторону образования продуктов реакции. Часто встречаются процессы при которых слабые электролиты или малорастворимые соединения входят в число исходных и в число конечных продуктов реакции. Например, HCN(p) + CH3COO-(p)↔ CH3COOH(p) + CN-(p) (1), ΔG˚=43кДж NH4OH(p) + H+(p) ↔ H2O(ж) + NH4+(p) (2) ΔG˚= -84кДж слабые электролиты есть и в левой и в правой части уравнений. В этих случаях равновесие обратимого процесса смещается в сторону образования вещества, обладающего меньшей Кдиссоц. В реакции (1) равновесие смещено влево KHCN = 4,9 · 10-10 < KCH3COOH = 1,8 · 10-5, в реакции (2) – сильно сдвинуто вправо (KH2O=1,8 · 10-16 < KNH4OH = 1,8 · 10-5). Примерами процессов в уравнении реакции которых слева и справа входят труднорастворимые вещества, могут служить: AgCl(k)↓ + NaI(p) ↔ AgI↓(k) + NaCl(p) (1) ΔG˚= - 54кДж BaCO3↓(k) + Na2SO4(p) ↔ BaSO4↓(k) + Na2CO3(p) (2) ΔG˚≈ 0 Равновесие смещается в сторону образования менее растворимого соединения. В реакции (1) равновесие смещено вправо, т.к. ПРAgI=1,1·10-16 < ПРAgCl =1,8· 10-10. В реакции (2) равновесие лишь несколько сдвинуто в сторону BaSO4 (ПР BaCO3 = 4,9·10-9 > ПР BaSO4 =1,08·10-10). Встречаются процессы в уравнениях которых с одной стороны равенства имеется малорастворимое соединение, а с другой стороны – слабый электролит. Так, равновесие в системе AgCN(k)↓ + H+(p) ↔ HCN(p) + Ag+(p) ΔG˚= - 46кДж значительно смещено вправо, поскольку ион СN- более прочно связывается в молекулу очень слабого электролита HCN, чем в молекулу малорастворимого вещества AgCN. Поэтому осадок AgCN растворяется при добавлении азотной кислоты.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 2244; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.120.103 (0.008 с.) |

 ;
; .
.