
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос) Закон Авогадро. Следствия из закона Авогадро.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Вопрос) Закон Авогадро. Следствия из закона Авогадро. Закон Авога́дро — одно из важных основных положений химии, гласящее, что «в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул». Было сформулировано ещё в 1811 году Амедео Авогадро (1776—1856), профессором физики в Турине. Следствия закона Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём. В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона:
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму. Положение это имело громадное значение для развития химии, так как оно дает возможность определять частичный вес[2] тел, способных переходить в газообразное или парообразное состояние. Если через m мы обозначим частичный вес тела, и через d — удельный вес[3] его в парообразном состоянии, то отношение m / d должно быть постоянным для всех тел. Опыт показал, что для всех изученных тел, переходящих в пар без разложения, эта постоянная равна 28,9, если при определении частичного веса исходить из удельного веса воздуха, принимаемого за единицу, но эта постоянная будет равняться 2, если принять за единицу удельный вес водорода. Обозначив эту постоянную, или, что то же, общий всем парам и газам частичный объём через С, мы из формулы имеем с другой стороны m = dC. Так как удельный вес параопределяется легко, то, подставляя значение d в формулу, выводится и неизвестный частичный вес данного тела. Элементарный анализ, например, одного из полибутиленов указывает, в нём пайное отношение углерода к водороду, как 1 к 2, а потому частичный вес его может быть выражен формулой СН2 или C2H4, C4H8 и вообще (СН2)n. Частичный вес этого углеводорода тотчас определяется, следуя закону Авогадро, раз мы знаем удельный вес, т. е. плотность его пара; он определен Бутлеровым и оказался 5,85 (по отношению к воздуху); т. е. частичный вес его будет 5,85 · 28,9 = 169,06. Формуле C11H22отвечает частичный вес 154, формуле C12H24 — 168, а C13H26 — 182. Формула C12H24 близко отвечает наблюденной величине, а потому она и должна выражать собою величину частицы нашего углеводорода CH2. 2-вопрос) Атомно-молекулярное учение. Относительная плотность. Приведите примеры. Атомно-молекулярное учение Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям.1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц. 4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов. Атомистическое учение в химии применил английский ученый Джон Дальтон. В своей основе учение Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает его дальше, поскольку Дальтон впервые пытался установить атомные массы известных тогда элементов. Однако Дальтон отрицал существование молекул у простых веществ, что по сравнению с учением Ломоносова является шагом назад. По Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества — из «сложных атомов» (в современном понимании — молекул). Отрицание Дальтоном существования молекул простых веществ мешало дальнейшему развитию химии. Атомно-молекулярное учение в химии окончательно утвердилось лишь в- середине XIX в.Молекула — это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением. Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям: атом — это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов. Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру. Основные положения атомно-молекулярного учения можно сформулировать так: · Существуют вещества с молекулярным и немолекулярным строением. · Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются. · Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает. · Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей — в газах. · Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении. · Атомы одного вида отличаются от атомов другого вида массой и свойствами. · При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. · У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решето находятся молекулы. Связи между молекулами, расположенными в узлах кристаллической решетки, слабые и при нагревании разрываются. Поэтому вещества с молекулярным строением, как правило, имеют низкие температуры плавления. · У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления. Объяснение физических и химических явлений с точки зрения атомно-молекулярного учения. Физические и химические явления получают объяснение с позиций атомно-молекулярного учения. Так, например, процесс диффузии объясняется способность молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому, что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки. Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ. Основные положения Атомно-молекулярная теория базируется на следующих законах и утверждениях: · Все вещества состоят из атомов · Атомы одного химического вещества (химический элемент) обладают одинаковыми свойствами, но отличаются от атомов другого вещества · При взаимодействии атомов образуются молекулы (гомоядерные — простые вещества, гетероядерные — сложные вещества) · При физических явлениях молекулы не изменяются, при химических происходит изменение их состава · Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества · Закон сохранения массы — масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции · Закон постоянства состава (закон кратных отношений) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами · Аллотропия — существование одного и того же химического элемента в виде нескольких простых веществ, различных по строению и свойствам.
Относительной плотностью вещества называют отношение плотности исследуемого вещества к плотности эталонного вещества. В качестве эталонной жидкости чаще всего используют дистиллированную воду, плотность которой при +20 °C равна 998,203 кг/м3, а при температуре максимальной плотности (+4 °C) составляет 999,973 кг/м3. Определение относительной плотности для жидкости при +20 °C обычно производят путём деления массы определенного объёма жидкости к массе воды этого же объёма при этой же температуре. При этом получают относительную плотность вещества относительно плотности воды при +20 °C и обозначают эту величину как Чтобы определить плотность вещества, необходимо относительную плотность умножить на величину абсолютной плотности воды при температуре измерения. Часто можно встретить величину относительной плотности
3 – вопрос) Химическое равновесие. Факторы, определяющие направление химических реакций. Приведите примеры. Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1] А2 + В2 ⇄ 2AB Смещение химического равновесия Основная статья: Принцип Ле Шателье — Брауна Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье. Факторы, влияющие на химическое равновесие: 1) температура При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции. CaCO3=CaO+CO2 -Q t↑ →, t↓ ← N2+3H2↔2NH3 +Q t↑ ←, t↓ → 2) давление При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся. CaCO3=CaO+CO2 P↑ ←, P↓ → 1моль=1моль+1моль 3) концентрация исходных веществ и продуктов реакции При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при повышении концентрации продуктов реакции-в сторону исходных веществ. S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ← Катализаторы не влияют на смещение химического равновесия! Описание В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление Окисление — процесс отдачи электронов, с увеличением степени окисления. При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов. В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см.Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле. Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель: окислитель + e− ↔ сопряжённый восстановитель. Восстановление Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается. При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидовметаллов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др. Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель: восстановитель — e− ↔ сопряжённый окислитель. Несвязанный, свободный электрон является сильнейшим восстановителем. Примеры Произведение растворимости
В случае низкой растворимости электролита образуется крайне разбавленный раствор, который близок к идеальному раствору и можно использовать концентрационную константу равновесия: Кс = Концентрация твердой фазы [К m А n (т)]=const, отсюда: Кс [К m А n (т)] = [ При постоянной температуре в насыщенном растворе произведение концентраций (или активностей) ионов, на которые диссоциирует электролит, с учетом показателей степеней, соответствующих стехиометрическим коэффициентам, есть величина постоянная. Она называется произведением растворимости (ПР) малорастворимого сильного электролита. Чем меньше значение ПР, тем хуже растворяется соединение. При внесении в раствор избытка ионов Условием образования осадка является превышение величины произведения концентраций ионов над величиной произведения растворимости: Сm ( Когда в растворе мала концентрация ионов, то Cm ( 14) Гидролиз солей. Привести примеры Гидро́лиз (от др.-греч. ὕδωρ — вода и λύσις — разложение) — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия. Идролиз солей
Гидролиз соли это обменное взаимодействие ионов соли с молекулами воды, в результате которого образуется слабый электролит и смещается равновесие электролитической диссоциации воды.- Среди обменных реакций с участием электролитов, протекающих в направлении образования слабых электролитов, различают четыре случая взаимодействия соли и воды. 1. Гидролиз практически не происходит, если соли образованы катионами сильного основания и анионами сильной кислотой. Например: KCl, NaNO3, CaSO4. Очевидно, что в этом случае единственным слабым электролитом является вода и взаимодействие типа KCl + H2 KOH + HClDO не нарушает равновесия Н2 НDО + + ОН–, т.е. в таких растворах рН=7 и равновесие практически полностью смещено влево. 2. Если соли образованы катионами сильного основания и анионами слабой кислоты (KCN, Na3PO4, CH3COOK и др.), то имеет место гидролиз по аниону. Пример, гидролиз соли К2СО3. I ступень: К2СО3 + Н2 КНСОDО 3 + КОН Уравнения гидролиза обычно записывают, указывая сильные электролиты в ионном виде, а слабые – в молекулярном. Данное уравнение может быть записано так: 2К+ + СО32– + Н2 КDО + + НСО3- + К+ + ОН- или в сокращенном виде: СО32- + Н2 НСОDО 3- + ОН-; Как правило, самопроизвольно гидролиз идет в этом случае в основном по I ступени. II ступень: КНСО3 + Н2 НDО 2СО3 + КОН или сокращенное ионно-молекулярное уравнение: НСО3- + Н2 НDО 2СО3 + ОН-. Видно, что гидролиз по аниону приводит к появлению избытка ионов ОН-, т. е. раствор становится щелочным (рН>7). Для усиления гидролиза по II ступени следует принять меры к сдвигу равновесия. 3. В случае, когда соль образована катионом слабого основания и анионом сильной кислоты (CuSO4, ZnCl2, NH4NO3 и т.п.), то происходит гидролиз по катиону. Пример, гидролиз соли ZnCl2. I ступень: ZnCl2 + H2 Zn(OH)Cl + HClDO или сокращенное ионно-молекулярное уравнение: Zn2+ + H2 Zn(OH)DO + + H+. II ступень: Zn(OH)Cl +H2 Zn(OH)DO 2 + HCl¯ или сокращенное ионно-молекулярное уравнение: Zn(OH)+ +H2 Zn(OH)DO 2 + H+. Избыток ионов водорода в этом случае обусловливает кислотную среду раствора (рН<7). 4. Если соли образованы катионами слабого основания и анионами слабой кислоты, то происходит гидролиз и по катиону и по аниону. Примером может служить гидролиз соли СН3СООNH4: CH3COONH4 + Н2 NHDО 4OH + CH3COOH. При этом протекают параллельно два процесса: NH4+ + H2 NHDO 4OH + H+ и CH3СОО- + Н2 CHDО 3COOH + ОН-. Растворы солей этого типа могут иметь слабокислотную или слабощелочную реакцию в зависимости от соотношения констант диссоциации образующихся при гидролизе кислоты и основания. Если слабые кислота и основание близки по силе, то гидролиз соли идет практически до конца.
15) Слабые электролиты. Константа и степень диссоциации. Закон разбавления Оствальда. Электроли́т — вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью. Слабые электролиты. Вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать большой концентрации ионов в растворе. К слабым электролитам относятся: 1) почти все органические кислоты (CH3COOH, C2H5COOH и др.); 2) некоторые неорганические кислоты (H2CO3, H2S и др.); 3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Ca(OH)2; Al(OH)3;NH4OH); 4) вода. Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещест ва состоят из ионов. При их растворении диполи воды ориен-тируются вокруг положительного и отрицательного ионов. Между иона-ми и диполями воды возникают силы взаимного притяжения. В результа-те связь между ионами ослабевает, происходит переход ионов из кристал-ла в раствор. При этом образуются гидратированные ионы, т.е. ионы, химически связанные с молекулами воды. Аналогично диссоциируют и электролиты, молекулы кото-рых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества также ориентируются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы, а положительными полюсами - к отрицательному полюсу Степень диссоциации Количественно процесс диссоциации вещества в растворе можно оценить по степени диссоциации L. Ее рассчитывают как отношение числа молекул электролита, распавшихся на ионы, к общему числу молекул растворенного вещества и выражают в процентах. L = Число молекул распавшихся на ионы \ Общее число молекул В зависимости от величины степени диссоциации все электролиты классифицируют: n на сильные (L > 30 %), n средней силы (L от 2 до 30 %), n слабые (L < 1 %). n Например: если же L = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы. Если L = 0, то диссоциация отсутствует, а если L = 1 или 100%, то электролит полностью распадается на ионы Закон разбавления Оствальда n n К дис = L2 * C / (1-L) – это выражение закона разбавления Оствальда n Для очень слабых электролитов степень диссоциации намного меньше 30% или 0,3, то 1 – L приблизительно равно 1, тогда Кдис. = L2 * C и L = Кдис./ С. n Таким образом, при разбавлении растворов слабых электролитов степень диссоциации возрастает. n Основные положения теории электролитической диссоциации следующие: n а) диссоциация электролитов происходит под действием полярных молекул растворителя; n б) диссоциация - обратимый процесс; n в) диссоциирующие молекулы распадаются на катионы — положительно заряженные частицы и анионы - отрицательно заряженные частицы; n г) суммарный заряд всех катионов равен суммарному заряду всех анионов; n д) под действием электрического тока в растворах электролитов начинается направленное движение ионов, катионы двигаются к катоду, а анионы — к аноду; n е) диссоциация многоосновных кислот и многокислотных оснований происходит ступенчато. 16) Оксид углерода (углекислый газ, диоксид углерода, двуокись углерода, угольный ангидрид) — CO2, бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом. Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,0395 %.[1] Плотность при нормальных условиях 1,97 кг/м³. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения. Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи. Углекислый газ в природе : Углекислый газ в атмосфере Земли
Изменения концентрации атмосферного углекислого газа (кривая Килинга). Измерения в обсерватории на горе Мауна-Лоа, Гавайи. Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария. Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) дает малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан). Большое количество углекислоты растворено в океане. Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Основным загрязнителем воздушного бассейна города Алматы является автотранспорт, выбросы которого составляют 80-90% от общего количества загрязняющих веществ, попадающих в атмосферу. Количество автотранспортных средств в городе неуклонно растет. По данным Управления дорожной полиции в 2008 году в городе было зарегистрировано более 530 тысяч автомобилей на 1,4 млн. жителей. По информации Центра гидрометеорологического мониторинга, ежедневно в городе отмечается многократное превышение предельно допустимых концентраций (ПДК) следующих веществ: диоксид азота, оксиды углерода, формальдегид и пыль (взвешенные вещества). Строение атмосферы Тропосфера Её верхняя граница находится на высоте 8—10 км в полярных, 10—12 км в умеренных и 16—18 км в тропических широтах; зимой ниже, чем летом. Нижний, основной слой атмосферы содержит более 80 % всей массы атмосферного воздуха и около 90 % всего имеющегося в атмосфере водяного пара. В тропосфере сильно развиты турбулентность и конвекция, возникают облака, развиваются циклоны и антициклоны. Температура убывает с ростом высоты со средним вертикальным градиентом 0,65°/100 м Тропопауза Переходный слой от тропосферы к стратосфере, слой атмосферы, в котором прекращается снижение температуры с высотой. Стратосфера Слой атмосферы, располагающийся на высоте от 11 до 50 км. Характерно незначительное изменение температуры в слое 11—25 км (нижний слой стратосферы) и повышение её в слое 25—40 км от −56,5 до 0,8 °С (верхний слой стратосферы или область инверсии). Достигнув на высоте около 40 км значения около 273 К (почти 0 °C), температура остаётся постоянной до высоты около 55 км. Эта область постоянной температуры называется стратопаузой и является границей между стратосферой и мезосферой. Стратопауза Пограничный слой атмосферы между стратосферой и мезосферой. В вертикальном распределении температуры имеет место максимум (около 0 °C). Мезосфера Мезосфера начинается на высоте 50 км и простирается до 80—90 км. Температура с высотой понижается со средним вертикальным градиентом (0,25—0,3)°/100 м. Основным энергетическим процессом является лучистый теплообмен. Сложные фотохимические процессы с участием свободных радикалов, колебательно возбуждённых молекул и т. д. обусловливают свечение атмосферы. Мезопауза Переходный слой между мезосферой и термосферой. В вертикальном распределении температуры имеет место минимум (около —90 °C). Линия Кармана Высота над уровнем моря, которая условно принимается в качестве границы между атмосферой Земли и космосом. В соответствии с определением ФАИ, линия Кармана находится на высоте 100 км над уровнем моря. Граница атмосферы Земли Принято считать, что граница атмосферы Земли и ионосферы находится на высоте 118 километров[3]. Это показывает анализ параметров движения высокоэнергетических частиц, перемещающихся в атмосфере и ионосфере. Термосфера Верхний предел — около 800 км. Температура растёт до высот 200—300 км, где достигает значений порядка 1500 К, после чего остаётся почти постоянной до больших высот. Под действием ультрафиолетовой и рентгеновской солнечной радиации и космического излучения происходит ионизация воздуха («полярные сияния») — основные области ионосферылежат внутри термосферы. На высотах свыше 300 км преобладает атомарный кислород. Верхний предел термосферы в значительной степени определяется текущей активностью Солнца. В периоды низкой активности — например, в 2008—2009 гг — происходит заметное уменьшение размеров этого слоя[4]. Термопауза Область атмосферы прилегающая сверху к термосфере. В этой области поглощение солнечного излучения незначительно и температура фактически не меняется с высотой. Экзосфера (сфера рассеяния)
Экзосфера — зона рассеяния, внешняя часть термосферы, расположенная выше 700 км. Газ в экзосфере сильно разрежён, и отсюда идёт утечка его частиц в межпланетное пространство (диссипация). До высоты 100 км атмосфера представляет собой гомогенную хорошо перемешанную смесь газов. В более высоких слоях распределение газов по высоте зависит от их молекулярных масс, концентрация более тяжёлых газов убывает быстрее по мере удаления от поверхности Земли. Вследствие уменьшения плотности газов температура понижается от 0 °C в стратосфере до −110 °C в мезосфере. Однако кинетическая энергия отдельных частиц на высотах 200—250 км соответствует температуре ~150 °C. Выше 200 км наблюдаются значительные флуктуации температуры и плотности газов во времени и пространстве.
19)Во́здух — естественная смесь газов (главным образом азота и кислорода - 98-99% в сумме, а также углекислого газа, воды, водорода и пр.) образующая земную атмосферу. Воздух необходим для нормального существования подавляющего числа наземных живых организмов: кислород, содержащийся в воздухе, в процессе дыхания поступает в клетки организма и используется в процессе окисления, в результате которого происходит выделение необходимой для жизни энергии (метаболизм, аэробы). Химический состав В 1754 году Джозеф Блэк экспериментально доказал, что воздух представляет собой смесь газов, а не однородное вещество.[1]
Состав воздуха может меняться: в крупных городах содержание углекислого газа будет выше, чем в лесах; в горах пониженное содержание кислорода, вследствие того, что кислород тяжелее азота, и поэтому его плотность с высотой уменьшается быстрее. В различных частях земли состав воздуха может варьироваться в пределах 1-3 % для каждого газа.[ источник не указан 1083 дня ] Воздух всегда содержит пары воды. Так, при температуре 0 °C 1 м³ воздуха может вмещать максимально 5 граммов воды, а при температуре +10 °C — уже 10 граммов.
20)Атмосфера — это газовая оболочка, которая окружает.Землю. Наличие атмосферы — одно из самых важных условий жизни на планете. Без еды человек может обходитися месяц, без воды — неделю, а без воздуха не проживет и нескольких минут. Атмосфера, как элемент глобальной экосистемы, выполняет несколько основных функций:
Значение атмосферы в природе и жизни человека огромно: - засчет газообразной оболочки поверхность планеты не нагревается днем и не остывает резко ночью; - регуляция теплового режима Земли, атмосфера защищает Землю от метеоритов, немалая пункт которых сгорает, не долетая до поверхности планеты; - озоновый экран (озоносфера) защищает человечество от избыточных ультрафиолетовых излучений, огромная доза которых губительна для организма; - кислород, содержащийся в атмосфере, необходим всем живым организмам для дыхания. - среда для распространения звука; - определение светового режима; - важный метод для воздушного транспорта. Ту пункт воздуха, которая примерно одинаковая во всех уголках Земли и немного изменяется за день, неделю либо даже год, назвали «постоянной составляющей атмосферы». Одной из главнейших составных атмосферы есть водный пар, который содержит огромную пространственно-временную изменяемость и сосредоточенный главным образом в тропосфере. Атмосферный воздух является неисчерпаемым природным ресурсам, общее определяется в 500 трлн.тн., из них - кислорода 105 трлн.тн. Ежегодное потребление кислорода 10 млрд.тн, т.е. 0,01%, правда кислородного голодания не предвидится, сейчас сложившийся состав атмосферы обязан быть сохранен, так как все живые организмы приспособлены к нему и создан на Земле самый благоприятный биологический режим. Источники загрязнения многочисленны и разнообразны и по собственной природе. Различают естественное и антропогенное загрязнение атмосферы. Естественное загрязнение появл
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1557; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.169 (0.017 с.) |

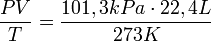 .
.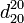 , где цифра сверху относится к исследуемому веществу, а снизу — к температуре воды. Определяют относительную плотность
, где цифра сверху относится к исследуемому веществу, а снизу — к температуре воды. Определяют относительную плотность 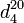 , которая показывает плотность исследуемого вещества относительно плотности воды при +4 °C. В справочниках также приводится для воды величина 0,99823, которая представляет собой относительную плотность воды
, которая показывает плотность исследуемого вещества относительно плотности воды при +4 °C. В справочниках также приводится для воды величина 0,99823, которая представляет собой относительную плотность воды 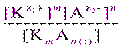 .
.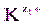 ] m [
] m [ 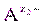 ] n = ПР = const. (9)
] n = ПР = const. (9)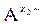 , изменятся концентрации ионов в растворе (сдвиг равновесия диссоциации влево по принципу Ле Шателье). Величина ПР останется постоянной при неизменной температуре, но выпадет дополнительное количество осадка
, изменятся концентрации ионов в растворе (сдвиг равновесия диссоциации влево по принципу Ле Шателье). Величина ПР останется постоянной при неизменной температуре, но выпадет дополнительное количество осадка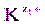 ×) Сn (
×) Сn (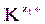 ×) Cn (
×) Cn ( ) < ПР, и электролит будет растворяться до тех пор, пока произведение концентраций ионов не сравняется со значением ПР.
) < ПР, и электролит будет растворяться до тех пор, пока произведение концентраций ионов не сравняется со значением ПР.



