
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристика квантовых чиселСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Основы квантовой теории теория, основы который были заложены в 1900 физиком Максом Планком. Согласно этой теории, атомы всегда излучают или принимают лучевую энергию только порциями, прерывно, а именно определенными квантами (кванты энергии), величина энергии которых равна частоте колебаний (скорость света, деленная на длину волны) соответствующего вида излучения, умноженной на планковский квант действия (см. Константа, Микрофизика, а также Квантовая механика). Квантовая теориябыла положена (гл. о. Эйнштейном) в основу квантовой теории света (корпускулярная теория света), по которой свет также состоит из квантов, движущихся со скоростью света (световые кванты, фотоны). Характеристика квантовых чисел 1)Главное квантовое число (n) — характеризует энергию и размер орбитали. Оно принимает значения от 1 до 2)Побочное (орбитальное) квантовое число (1) - характеризует форму орбиталей и принимает значения от 0 до (n - 1): 1 = О, 1, 2, 3, 4. Например, если n = 2, то 1 имеет 2 значения: О, 1. Значит, на 2 энергетическом уровне есть сферическая орбиталь (1 = 0) и в виде объемной восьмерки (гантелеобразная) (1 = 1). 3)Магнитное квантовое число (m) - характеризует количество орбиталей одинаковой формы и ориентацию их в электромагнитном поле ядра атома. Оно принимает значения в интервале от —1 до +1. Для каждого значения разрешено (21 + 1) значений числа m. Например, если 1 = 1, то m имеет (2 x 1 + 1) 3 значения: — 1,0, +1. 4)Спиновое квантовое число (s) - характеризует вращение электрона вокруг своей оси и принимает только 2 значения: +1/2 ( Правило Гунда Правило Гунда (Хунда). Заполнение электронами ячеек p-, d- и f-подуровней вначале происходит неспаренными электронами, и лишь после такого заполнения подуровня начинается вхождение в ячейки вторых электронов (с противоположными спиновыми квантовыми числами), т. е. происходит их спаривание. Принцип Паули Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом. Вообще, принцип Паули является критерием к разделению частиц==>он справедлив для "всех" частиц 5. Принцип наименьшей энергии: электроны в первую очередь заполняют свободные орбитали с наименьшей энергией. В многоэлектронных атомах энергия орбиталей определяется не только взаимодействием электронов с ядром, но и взаимодействием электронов между собой. Это проводит к появлению ряда нарушений вышеприведенной последовательности у отдельных d и f-элементов. Явление носит название провал электрона; проявляется в заполнении орбиталей с более высокой энергией при наличии незаполненных орбиталей с более низкой энергией. Правило Клечковского Правило n + l, или правило Клечковского. Энергия электрона в атоме определяется значениями главного n и побочного l квантовых чисел, поэтому сначала заполняются электронами те энергетические уровни и подуровни, для которых сумма значений квантовых чисел n + l минимальна. Если для двух подуровней одного или разных уровней суммы n + l равны, то сначала заполняется подуровень с меньшим значением n. Радиусы атомов и ионов Атомные радиусы разделяют на металлические, которые мы находим в металлах, сплавах или интерметаллических (?) соединениях, и ковалентные, характерные для неметаллов и вообще для ковалентных молекул. Ковалентные радиусы в свою очередь подразделяют на тетраэдрические, октаэдрические и т.д. Безусловно нужно различать радиусы при одинарной, двойной и тройной связях. Существуют ещё атомные радиусы по Брэггу–Слейтеру и орбитальные радиусы. Ван-дер-ваальсовы радиусы следует рассматривать как радиусы несвязанных атомов. Их находят по межатомным расстояниям в твердом теле или жидкости, где атомы находятся в непосредственной близости друг от друга, но не связаны между собой ионной, ковалентной или металлической связью. Ковалентные радиусы За ковалентный радиус атома при одинарной связи принимают половину расстояния между ядрами 2х одинаковых атомов, связанных ковалентной связью. Ионные радиусы Измерить межъядерное расстояние в молекуле несложно, но решить какая часть этого расстояния приходится на долю катиона, а какая на долю аниона, далеко не просто. Элетктроотрицательность Электроотрицательность атома, величина, характеризующая способность атома в молекуле притягивать электроны, участвующие в образовании химической связи. Известно несколько способов вычисления Э. Так, согласно Р. Малликену (1935), мерой Э. может служить сумма ионизационного потенциала атома и его сродства к электрону; Л. Полингпредложил (1932) другой, более сложный способ вычисления Э. (см. в ст. Химическая связь).Оказалось, однако, что все способы практически приводят к одинаковым результатам. Зная Э., можно приближённо оценить распределение электронной плотности в молекулах многих химических веществ, например определить полярность ковалентной связи. Ионизационные потенциалы Ионизационный потенциал, потенциал ионизации, физическая величина, определяемая отношением наименьшей энергии, необходимой для однократной ионизации атома (или молекулы), находящегося в основном состоянии, к заряду электрона. И. п. — мера энергии ионизации, которая равна работе вырывания электрона из атома или молекулы и характеризует прочность связи электрона в атоме или молекуле. И. п. принято выражать в в, численно он равен энергии ионизации в эв. Сродство к электрону Сродство атома к электрону A e - способность атомов присоединять добавочный электрон и превращаться в отрицательный ион. Мерой сродства к электрону служит энергия, выделяющая или поглощающаяся при этом. Сродство к электрону равно энергии ионизации отрицательного иона Х−: Х− = Х + е − Наибольшим сродством к электрону обладают атомы галогенов. Например, для атома фтора присоединение электрона сопровождается выделением 327,9 кДж/моль энергии. Для ряда элементов сродство к электрону близко к нулю или отрицательно, что значит отсутствие устойчивого аниона для данного элемента. Объяснение этому можно дать, основываясь на меньших размерах первых атомов и большем электрон-электронном отталкивании в них. Химическая связь, ее типы Метод валентных связей Основные принципы образования химической связи по МВС: 1. Химическая связь образуется за счет валентных (неспаренных) электронов. 2. Электроны с антипараллельными спинами, принадлежащие двум различным атомам, становятся общими. 3. Химическая связь образуется только в том случае, если при сближении двух и более атомов полная энергия системы понижается. 4. Основные силы, действующие в молекуле, имеют электрическое, кулоновское происхождение. 5. Связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Существует два механизма образования ковалентной связи Обменный механизм. Связь образована путем обобществления валентных электронов двух нейтральных атомов. Каждый атом дает по одному неспаренному электрону в общую электронную пару Кристаллические решетки Кристаллические решётки веществ-это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства. Точки размещения частиц называют узлами кристаллической решётки. Ионными называют кристаллические решетки, в узлах которых находятся ионы. Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными и неполяриыми.
Тепловой эффект Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов. Энтальпия Энтальпия, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц. Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении. Энтропия Энтропия — это сокращение доступной энергии вещества в результате передачи энергии. Первый закон термодинамики гласит, что энергию невозможно создать или уничтожить. Следовательно, количество энергии во вселенной всегда такое же, как было и при ее создании. Второй закон термодинамики гласит, что коэффициент полезного действия ни одного реального (необратимого) процесса не может быть 100% при преобразовании энергии в работу.
где Δ S — изменение энтропии, Δ Q — изменение теплоты, T — абсолютная термодинамическая температура. Энергия Гиббса Энергией Гиббса (или потенциалом Гиббса, или просто термодинамическим потенциалом в узком смысле) называют термодинамический потенциал следующего вида:
где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S — энтропия. Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т.д.) Закон Гесса Закон Гесса — основной закон термохимии, который формулируется следующим образом: · Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы. Первый закон термодинамики
Первый закон термодинамики - количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
26.Уравнение Гиббса
где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S — энтропия. Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т.д.) Дифференциал энергии Гиббса для системы с постоянным числом частиц:
Для системы с переменным числом частиц этот дифференциал записывается так:
Здесь Закон действия масс Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ. В химической термодинамике закон действующих масс связывает между собой равновесные активности исходных веществ и продуктов реакции, согласно соотношению:
Уравнение Вант-Гоффа Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале Уравнение, которое описывает это правило, следующее:
где
Температура При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении - в сторону экзотермической (выделение) реакции. Давление При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении - в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся. Катализ - избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий 33. Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Законы Рауля. Первый закон Рауля (1887 г). Выражает зависимость относительного понижения давления насыщенного пара растворителя от концентрации раствора неэлектролита. Относительное понижение давления насыщенного пара растворителя над раствором нелетучих веществ равно мольной доле растворенного вещества. Второй закон Рауля определяет зависимость температуры кристаллизации и кипения раствора от концентрации растворенного вещества: Повышение температуры кипения и понижение температуры кристаллизации разбавленных идеальных растворов пропорциональны моляльной концентрации растворенного вещества. Диффузия и осмос. О́смос — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя). Диффу́зия — процесс взаимного проникновения молекул или атомов одного вещества между молекулами или атомами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму Типы ОВР Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например: Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например: Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например: Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления. Виды коррозии. Коррозионные процессы отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Поэтому пока нет единой и всеобъемлющей классификации встречающихся случаев коррозии. По типу агрессивных сред, в которых протекает процесс разрушения. По условиям протекания коррозионного процесса По характеру разрушения Электрохимическая коррозия Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией Химическая коррозия — взаимодействие поверхности металла с коррозионно-активной средой, не сопровождающееся возникновением электрохимических процессов на границе фаз Виды защиты от коррозии Цинкование — это процесс нанесения цинка или его сплава на металлическое изделие для придания его поверхности определённых физико-химических свойств Система холодного цинкования предназначена для усиления антикоррозионных свойств комплексного многослойного покрытия. Система обеспечивает полную катодную (или гальваническую) защиту железных поверхностей от коррозии в различных агрессивных средах Газотермическое напыление Создание слоя из другого металла/сплава, обладающий более высокой стойкостью к коррозии
51. Ингибиторы коррозии – вещества, которые, находясь в коррозионной среде в достаточной концентрации, сильно замедляют либо вообще прекращают коррозионное разрушение металла. Ингибитором коррозии может быть как одно соединение, так и смесь нескольких. Пассиваторы – вещества, с помощью которых металлическую поверхность переводят в пассивное состояние. Чаще всего пассиваторы – неорганические вещества, которые обладают окислительными свойствами (хроматы, молибдаты, нитраты).
Основы квантовой теории теория, основы который были заложены в 1900 физиком Максом Планком. Согласно этой теории, атомы всегда излучают или принимают лучевую энергию только порциями, прерывно, а именно определенными квантами (кванты энергии), величина энергии которых равна частоте колебаний (скорость света, деленная на длину волны) соответствующего вида излучения, умноженной на планковский квант действия (см. Константа, Микрофизика, а также Квантовая механика). Квантовая теориябыла положена (гл. о. Эйнштейном) в основу квантовой теории света (корпускулярная теория света), по которой свет также состоит из квантов, движущихся со скоростью света (световые кванты, фотоны). характеристика квантовых чисел 1)Главное квантовое число (n) — характеризует энергию и размер орбитали. Оно принимает значения от 1 до 2)Побочное (орбитальное) квантовое число (1) - характеризует форму орбиталей и принимает значения от 0 до (n - 1): 1 = О, 1, 2, 3, 4. Например, если n = 2, то 1 имеет 2 значения: О, 1. Значит, на 2 энергетическом уровне есть сферическая орбиталь (1 = 0) и в виде объемной восьмерки (гантелеобразная) (1 = 1). 3)Магнитное квантовое число (m) - характеризует количество орбиталей одинаковой формы и ориентацию их в электромагнитном поле ядра атома. Оно принимает значения в интервале от —1 до +1. Для каждого значения разрешено (21 + 1) значений числа m. Например, если 1 = 1, то m имеет (2 x 1 + 1) 3 значения: — 1,0, +1. 4)Спиновое квантовое число (s) - характеризует вращение электрона вокруг своей оси и принимает только 2 значения: +1/2 ( Правило Гунда Правило Гунда (Хунда). Заполнение электронами ячеек p-, d- и f-подуровней вначале происходит неспаренными электронами, и лишь после такого заполнения подуровня начинается вхождение в ячейки вторых электронов (с противоположными спиновыми квантовыми числами), т. е. происходит их спаривание. Принцип Паули Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом. Вообще, принцип Паули является критерием к разделению частиц==>он справедлив для "всех" частиц 5. Принцип наименьшей энергии: электроны в первую очередь заполняют свободные орбитали с наименьшей энергией. В многоэлектронных атомах энергия орбиталей определяется не только взаимодействием электронов с ядром, но и взаимодействием электронов между собой. Это проводит к появлению ряда нарушений вышеприведенной последовательности у отдельных d и f-элементов. Явление носит название провал электрона; проявляется в заполнении орбиталей с более высокой энергией при наличии незаполненных орбиталей с более низкой энергией. Правило Клечковского Правило n + l, или правило Клечковского. Энергия электрона в атоме определяется значениями главного n и побочного l квантовых чисел, поэтому сначала заполняются электронами те энергетические уровни и подуровни, для которых сумма значений квантовых чисел n + l минимальна. Если для двух подуровней одного или разных уровней суммы n + l равны, то сначала заполняется подуровень с меньшим значением n.
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 2462; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.1.100 (0.013 с.) |

 : n = 1, 2, 3, 4, 5, 6, 7.
: n = 1, 2, 3, 4, 5, 6, 7. ). (Спин электрона — свойство электрона вести себя как крошечный магнит).
). (Спин электрона — свойство электрона вести себя как крошечный магнит).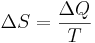 ,
,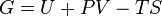 ,
,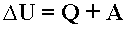 Первый закон термодинамики - Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно сумме количества теплоты, подведенного к системе извне, и работы внешних сил, действующих на нее:
Первый закон термодинамики - Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно сумме количества теплоты, подведенного к системе извне, и работы внешних сил, действующих на нее: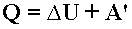
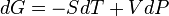 .
.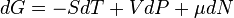 .
.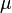 — химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.
— химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.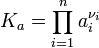 где
где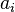 — активность веществ. Вместо активности могут быть использованы концентрация (для реакции в идеальном растворе), парциальные давления (реакция в смеси идеальных газов), фугитивность (реакция в смеси реальных газов);
— активность веществ. Вместо активности могут быть использованы концентрация (для реакции в идеальном растворе), парциальные давления (реакция в смеси идеальных газов), фугитивность (реакция в смеси реальных газов); — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным);
— стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным);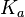 — константа химического равновесия. Индекс «a» здесь означает использование величины активности в формуле.
— константа химического равновесия. Индекс «a» здесь означает использование величины активности в формуле.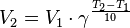
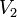 — скорость реакции при температуре
— скорость реакции при температуре  ,
, 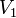 — скорость реакции при температуре
— скорость реакции при температуре 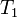 ,
, 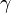 — температурный коэффициент реакции
— температурный коэффициент реакции


