
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость хим реакций и факторы влияющие на нееСодержание книги Поиск на нашем сайте
Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: · природа реагирующих веществ, · наличие катализатора, · температура (правило Вант-Гоффа), · давление, · площадь поверхности реагирующих веществ. Закон действия масс Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ. В химической термодинамике закон действующих масс связывает между собой равновесные активности исходных веществ и продуктов реакции, согласно соотношению:
Уравнение Вант-Гоффа Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале Уравнение, которое описывает это правило, следующее:
где
Уравнение Аррениуса. Энергия активации. Энергия активации в химии и биологии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:
где k — константа скорости реакции, С повышением температуры растёт вероятность преодоления энергетического барьера.
|
|||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 313; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.72.200 (0.01 с.) |

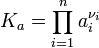 где
где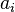 — активность веществ. Вместо активности могут быть использованы концентрация (для реакции в идеальном растворе), парциальные давления (реакция в смеси идеальных газов), фугитивность (реакция в смеси реальных газов);
— активность веществ. Вместо активности могут быть использованы концентрация (для реакции в идеальном растворе), парциальные давления (реакция в смеси идеальных газов), фугитивность (реакция в смеси реальных газов); — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным);
— стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным);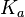 — константа химического равновесия. Индекс «a» здесь означает использование величины активности в формуле.
— константа химического равновесия. Индекс «a» здесь означает использование величины активности в формуле.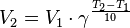
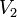 — скорость реакции при температуре
— скорость реакции при температуре  ,
, 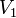 — скорость реакции при температуре
— скорость реакции при температуре 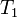 ,
, 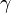 — температурный коэффициент реакции
— температурный коэффициент реакции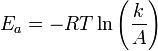 ,
, — фактор частоты для реакции,
— фактор частоты для реакции,  — универсальная газовая постоянная,
— универсальная газовая постоянная,  — температура в кельвинах.
— температура в кельвинах.


