
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
По синтезу органического соединенияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Студент готовит проект отчёта до начала занятия в строгом соответствии с предлагаемой формой: 1. Дата 2. Лабораторная работа №. 3. Название темы и метода синтеза. 4. Краткая характеристика указанного метода синтеза. 4.1. Перечень важнейших органических соединений, которые синтезируют данным методом. 4.2. Сырьё (т.е. какие углеводороды или их производные используют в синтезах по данному методу). 4.3. Реагенты (органические и неорганические), ряд их активности. 4.4. Важнейшие схемы механизмов. 5. Название синтеза, выполняемого студентом на занятии. 6. Уравнение реакций. 7. Схема установки для синтеза или очистки препарата. 8. Пропись синтеза. 9. Формулировка этапов синтеза. 10. Реактивы. 11. Таблица № 1. 12. Запись расчёта теоретического выхода. 13. Таблица № 2. 14. Запись расчётов выхода продукта в %. 15. Заключение. Таблица № 1
Свойства и количества исходных веществ, применяемых в синтезе
Таблица № 2 Характеристика и выход продукта синтеза
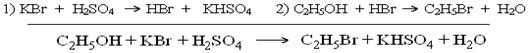
Образец оформления отчёта 1. Дата выполнения…... 2. Лабораторная работа №3. 3. Галогеноуглеводороды. Метод галогенирования. 4. Галогенирование используется в двух вариантах. Метод прямого галогенирования и метод непрямого галогенирования. 4.1. Методом галогенирования синтезируют органические соединения и фармпрепараты: хлороформ, бромэтан, хлорэтан, йодэтан, йодоформ, хлорбензол, бромбензол, бромкамфору, 5-бромфурфурол, α-бромнафталин, сим.-триброманилин и др.. 4.2. В качестве сырья (субстрата) используют при прямом галогенировании алканы, алкены, алкины, бензол, толуол, нафталин, пиррол, фурфурол, карбоновые кислоты и т.д. В качестве сырья при непрямом галогенировании используют спирты, кетоны, альдегиды. 4.3. В качестве галогенирующих агентов используют галогены: Cl2, Br2, I2; галогеноводороды: HCl, HBr,HI; хлористый тионил SOCl2, хлористый сульфурил SO2Cl2, хлорсульфоновую кислоту HSO3Cl, PCl5, PCl3, PI3, PI5. Активность галогенов меняется в ряду: Cl2> Br2> I2, активность галогенводородов меняется в ряду: HI > HBr > HCl. Наиболее активными галогенирующими агентами являются хлорсульфоновая кислота, пентахлорид фосфора. 4.4. Механизм галогенирования в зависимости от сырья. Галогенирование алканов протекает по радикально - цепному механизму (SR). Галогенирование алкенов протекает по механизму электрофильного присоединения по схеме:
Галогенирование бензола протекает по механизму электрофильного замещения по схеме (SE):
Непрямое галогенирование спиртов протекает по механизму нуклеофильного замещения:
Синтез бромэтана 6. Химизм синтеза бромэтана:
Суммарное уравнение: 7. Схема установки для перегонки с дефлегматором (рис. 1): …… 8. Пропись синтеза. ……….. 9. Главные этапы синтеза бромэтана: 1) Приготовление реагентов. 2) Сборка установки. 3) Синтез бромэтана с одновременной отгонкой в установке с дефлегматором. 4) Отделение бромэтана от воды в делительной воронке. 5) Сушка бромэтана безводным хлоридом кальция, отделение бромэтана методом фильтрования при атмосферном давлении. 6) Простая перегонка, определение температуры кипения. 7) Определение выхода бромэтана. 10. Реактивы: Этиловый спирт (d=0,81) 10 мл, бромид калия 15 г, серная кислота (d=1,84) 19 мл, лед, хлорид кальция (б/в). 11. Расчетные формулы, используемые для заполнения таблицы 1:
где n – количество вещества (моль); M –молярная масса вещества (г/моль). г) Масса теоретического выхода продукта реакции ( mтеорет. ) рассчитывается по количеству реагента, который находится в недостатке с учетом стехиометрических коэффициентов в уравнение реакции, например, для бромэтана, если бромид калия находится в недостатке, то в соответствии с уравнением реакции и учетом стехиометрических коэффициентов: n (KBr) = n (C2H5Br) = 0,126 (моль), тогда mтеорет. (C2H5Br) = n (C2H5Br) · М = 0,126 · 109 = 13,73 (г). 12. Заполнение таблицы 1: Таблица № 1 Свойства и количества исходных веществ, применяемых в синтезе
13. Заполнение таблицы 2: Таблица № 2. Характеристика и выход продукта синтеза
14. Выход продукта реакции (h) рассчитывается по формулам:
h (% от теорет.) C2H5Br = 10,5: 13,73 · 100% = 76,5 %. h (% от указан.) C2H5Br = 10,5: 11,5.. · 100% =91,3 %. 15. Вывод: провели синтез бромэтана с выходом от теоретического 76,5 %.
Лабораторная работа №3 Синтез бромэтана Реактивы: Этиловый спирт (d=0,81) 10 мл, бромид калия 15 г, серная кислота (d=1,84) 19 мл, лед, хлорид кальция (б/в). Посуда: круглодонная колба (50 мл), дефлегматор, насадка Вюрца, холодильник Либиха, аллонж, приемник, делительная воронка, фарфоровый стакан (100 мл), ступка, пробирки, держатель для пробирок.
Химизм процесса. Бромэтан получают по реакциям:
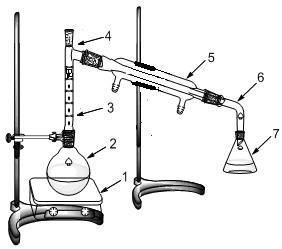
Пропись синтеза. В фарфоровом стакане на 100 мл, предварительно поставленном в ледяную баню, готовят реакционную смесь. Сначала вливают спирт 10 мл и воды 10 мл, затем при постоянном охлаждении (не выше 20оС) и перемешивании приливают (осторожно!) 19 мл концентрированной серной кислоты. В охлаждённую до комнатной температуры смесь, добавляют бромид калия, который предварительно растирают в ступке. Затем приготовленную реакционную смесь переносят в круглодонную колбу на 50 мл (колба закреплена в штативе Бунзена) с использованием конической воронки. В приёмник наливают ~20-30 мл воды и добавляют кусочки льда для того, чтобы уменьшить испарение продукта реакции. Конец аллонжа должен быть опущен ниже уровня воды. Собирают установку для перегонки с дефлегматором (рис.1):
Рис.1. Схема установки для перегонки с дефлегматором Реакционную смесь нагревают на песчаной бане до тех пор, пока в приёмник не перестанут поступать маслянистые капли, опускающиеся на дно. Если реакционная смесь в колбе начнёт сильно пениться, то на короткое время прерывают нагревание. По окончании реакции отделяют при помощи делительной воронки бромэтан от воды и собирают его в плоскодонную колбу. Для осушки бромэтана в колбу добавляют несколько кусочков прокалённого хлористого кальция, колбу закрывают притертой пробкой и ставят в ледяную баню. Через 10-15 мин бромэтан становится прозрачным и его перегоняют в установке с дефлегматором на водяной бане в интервале температур 36-40 Температура кипения чистого бромэтана 38 Контрольные вопросы 1. Один из исходных продуктов берут в избытке. Какой? 2. Для чего в реакционную массу добавляется вода? 3. Какова концентрация серной кислоты в реакционной массе? Как это может влиять на протекание побочных реакций? Напишите уравнение побочной реакции. 4. С какой целью продукт реакции постоянно удаляют из реакционной смеси? 5. Как определить конец отгонки бромэтана? 6. Почему прокаленный хлорид кальция может использоваться как осушитель для бромэтана?
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-13; просмотров: 1845; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.99.221 (0.008 с.) |


 пл. или t
пл. или t 


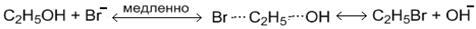


 где m - масса раствора (г); d –плотность (г/мл); V-объем раствора (мл).
где m - масса раствора (г); d –плотность (г/мл); V-объем раствора (мл). где m - масса вещества (г); w – массовая доля вещества (%); m – масса раствора (г).
где m - масса вещества (г); w – массовая доля вещества (%); m – масса раствора (г).

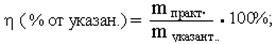
 C. Для предотвращения испарения продукта приемник помещают в ледяную баню и прикрывают отверстие ватой. Затем определяют показатель преломления бромэтана.
C. Для предотвращения испарения продукта приемник помещают в ледяную баню и прикрывают отверстие ватой. Затем определяют показатель преломления бромэтана.


