
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Выпадение тяжелых металлов на етр в начале XXI В.Содержание книги
Поиск на нашем сайте
Загрязнение атмосферы в ряде случаев может сопровождаться негативными явлениями на региональном уровне — возникновением в городах фотохимического смога и выпадением кислотных осадков на значительных техносферных и природных территориях. Общая схема реакций образования фотохимического смога в городах сложна и в упрощенном виде может быть представлена реакциями NO2 + hv - NO + О О + O2 - O3
Смог весьма токсичен, так как его составляющие обычно находятся в пределах: 03 — 60—75%; ПАН, Н202, альдегиды и др. - 25-40%. Для образования смога в атмосфере в солнечную погоду необходимо наличие оксидов азота и углеводородов (их выбрасывают в атмосферу автотранспорт, промышленные предприятия). Характерное распределение фотохимического смога по времени суток показано на рис. 5.28 (здесь Фотохимические смоги, впервые обнаруженные в 40-х гг. XX в. в Лос-Анджелесе, теперь периодически наблюдаются в городах мира, где широко используется печное отопление и массовый автотранспорт. Кислотные дожди известны более 100 лет, однако проблема влияния этих дождей на природу и человека возникла около 35 лет назад. Источниками кислотных дождей служат газы, содержащие серу и азот. Основными из них являются S02, N0 Основными в атмосфере являются следующие реакции: I вариант: S02+ ОН˙→ HS03; HS03 + ОН˙→Н2S04 (молекулы в атмосфере быстро конденсируются в капли; здесь ОН˙— свободный радикалl); II вариант: S02 + hv → S02 ˙(S02 ˙— молекула диоксида серы, находящаяся в возбужденном состоянии под действием гамма-кванта светового излучения); S02 + 02 →S04; S04 + 02 → S03 + Оз; S03 + Н2 О → Н2S04. Реакции обоих вариантов в атмосфере идут одновременно. Для сероводорода характерна реакция Н2S + 02 → S02 + Н2О и далее осуществление I или II вариантов реакции. Источниками поступления соединений серы в атмосферу являются следующие источники: естественные (вулканическая деятельность, действия микроорганизмов и др.) — 31—41%, антропогенные (ТЭС, промышленность и др.) — 59—69%; всего поступает 91—112 млн. т в год. Концентрации соединений азота (мкг/м3) достигают следующих значений: в городе — 10—100, на территории около города в радиусе 50 км — 0,25—2,5, над океаном — 0,25. Из соединений азота основной вклад в прохождение кислотных дождей дают NO и N02. В атмосфере возникают реакции: 2NO + 02 → 2N02; N02+ ОН˙ → HNO
естественные (почвенная эмиссия, грозовые разряды, горение биомассы и др.) — 63%, антропогенные (ТЭС, автотранспорт, промышленность) — 37%; всего поступает 51—61 млн. т в год. Серная и азотная кислоты поступают в атмосферу также в виде тумана и паров от промышленных предприятий и автотранспорта. В городах их концентрация достигает 2 мкг/м3. Соединения серы и азота, попавшие в атмосферу, вступают в химическую реакцию не сразу, а в течение некоторого промежутка времени, сохраняя свои свойства 2 и 8—10 сут соответственно. За это время они могут вместе с атмосферным воздухом пройти расстояния 1000—2000 км и лишь после этого выпадают с осадками на земную поверхность. Различают два вида седиментации: влажную и сухую. Влажная — это выпадение кислот, растворенных в капельной влаге, она возникает при влажности воздуха 100,5%; сухая реализуется в тех случаях, когда кислоты присутствуют в атмосфере в виде капель диаметром около 0,1 мкм. Скорость седиментации в этом случае весьма мала, и капли могут проходить большие расстояния (следы серной кислоты обнаружены даже на Северном полюсе). В нашей стране повышенная кислотность осадков (рН = 4÷5.5)отмечается в отдельных промышленных регионах. Наиболее неблагополучными являются города Тюмень, Тамбов, Архангельск, Северодвинск, Вологда, Петрозаводск, Омск и др. Плотность выпадения осадков серы, превышающая 4 т/км2 в год, зарегистрирована в 22 городах страны, а более 8—12 т/км2 в год — в городах Алексине, Новомосковске, Норильске, Магнитогорске. Возникновение таких глобальных проблем, как парниковый эффект и разрушение озонового слоя верхних слоев атмосферы, также связаны с поступлением в атмосферу различных примесей. Парниковый эффект. Суть его заключается в том, что Земля поглощает солнечное излучение (преимущественно в видимом диапазоне) и испускает теплоту в инфракрасном диапазоне. Главными поглотителями теплового излучения от земной поверхности служат диоксид углерода, метан и некоторые другие атмосферные примеси. Эти атмосферные примеси действуют подобно прозрачной крыши парника, пропуская к Земле коротковолновую часть спектра и задерживая у Земли длинноволновое тепловое излучение. Отсюда происходит и их название — парниковые газы. Чем выше их концентрация в атмосфере, тем выше парниковый эффект. Рост содержания С02 в атмосфере обусловлен потреблением углеводородных видов топлива — газа, нефти, угля. Другой источник С02 связан с изменениями растительного и почвенного покрова континентов. Вырубка лесов, а также распашка целинных земель и общая интенсификация земледелия приводят к более быстрому извлечению углерода из гумуса почв. За последние сто лет сжигание топлива дало выброс в атмосферу в среднем около 168 Гт углерода, а эмиссия вследствие изменения растительности континентов и необратимого нарушения почвенного покрова за это же время оценивается средней величиной 68 Гт углерода. Основным каналом стока избыточного углерода из атмосферы является океаносфера. Около 60% углерода поглощается океанами, а остальное количество — биотой континентов. Современная человеческая деятельность вносит значительные изменения в процесс функционирования морских экосистем. Через несколько десятилетий Мировой океан из-за загрязнения будет поглощать избыточный углерод менее эффективно, а доля остающегося в океаносфере С02 станет выше. Метан поступает в атмосферу из природных и техногенных источников. К природным источникам относятся донные отложения водоемов и болот. Техногенными источниками являются сельскохозяйственное производство, свалки бытовых отходов. Техногенные источники оксида азота (I) N20 связаны в основном с высокотемпературным окислением молекулярного азота в процессе горения различных видов топлива. В естественных условиях N20 поступает в атмосферу из почв, лесов и при грозовых разрядах. Из-за высокой химической инертности и малой растворимости в воде среднее время жизни N20 в атмосфере велико и составляет 120—150 лет. Хлорфторуглеводороды (фреоны) с середины 1930-х гг. находят широкое применение в промышленности. Фреон-11 и фреон-12 использовались в качестве вспенивателей при получении пористых полимерных материалов, наполнителей в аэрозольных упаковках, а также хладагентов в холодильниках и кондиционерах. Во второй половине 1980-х гг. во многих промышленно развитых странах были введены ограничения на производство и потребление этой продукции в связи с достигнутыми международными договоренностями о постепенном отказе от использования фторхлоруглеродов. Однако концентрации фреонов в атмосфере будут увеличиваться еще долгие годы даже после полного прекращения их производства, поскольку среднее время пребывания фреона-11 и фреона-12 в атмосфере оценивается примерно в 55—120 лет. Кроме того, значительные концентрации фреона-11 и фреона-12 и некоторых других соединений этого класса были зарегистрированы в газовых выбросах действующих вулканов и гидротермальных источников в сейсмически активных районах. Увеличение концентрации диоксида углерода в атмосфере (особенно интенсивное в последние годы) приводит к росту эффективности поглощения инфракрасного излучения. В качестве примера на рис. 5.29 отображена тенденция роста углекислого газа в последние десятилетия XX в., в результате чего температура Земли возрастает. К повышению температуры может привести и увеличение концентрации в атмосфере таких газов, как 03, СН4, N20, N02, S02, фреоны. Относительный вклад в парниковый эффект различных газов, возникающий при хозяйственной деятельности, показан в табл. 5.18
Таблица 5.18 Вклад парниковых газов
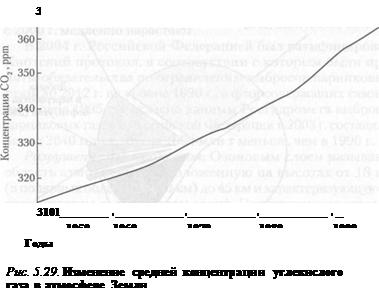
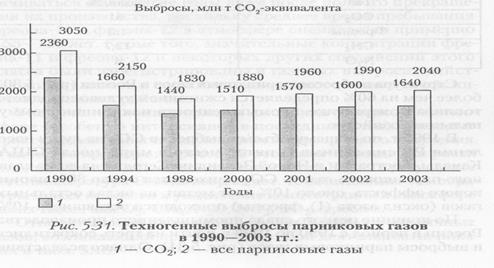
Структура выбросов парниковых газов в России (рис. 5.30) более чем на 60% определяется сжиганием углеводородного топлива в энергетике, промышленности и жилищно-коммунальном хозяйстве. В 1995 г. по общему объему выбросов С02 на душу населения Россия занимала пятое место в мире, после США, Канады, Австралии и Новой Зеландии. Сегодня на долю главного парникового газа — С02 приходится около 80% парникового эффекта, около 10% дает метан, на вклад остальных газов (оксид азота (I), фреоны) приходятся оставшиеся 10%. По причине резкого спада промышленного производства России в период с 1990 по 1999 г. почти на треть сократились и выбросы парниковых газов (рис. 5.31). Однако вследствие экономического роста выбросы парниковых газов начиная с 2000 г. медленно нарастают.
В 2004 г. Российской Федерацией был ратифицирован Киотский протокол, в соответствии с которым были приняты обязательства по ограничению выбросов парниковых газов до 2012 г. на уровне 1990 г., а фторсодержащих газов — на уровне 1995 г. Согласно данным Росгидромета выбросы парниковых газов в Российской Федерации в 2003 г. составили около 2040 млн т, что на 1000 млн т меньше, чем в 1990 г. Разрушение озонового слоя. Озоновым слоем называют область атмосферы, расположенную на высотах от 18 км (в полярных областях от 10 км) до 45 км и характеризующуюся повышенным содержанием озона. Поглощение озоновым слоем большей части биологически активного ультрафиолетового излучения Солнца с длиной волны λ < 310 нм и перевод его в теплоту играет важнейшую роль в сохранении жизни на Земле. Во-первых, озон является единственным компонентом атмосферного воздуха, защищающим все живое на суше от губительных доз ультрафиолетового облучения в диапазоне длин волн λ = 240÷310 нм. Во-вторых, нагревая атмосферу, озоновый слой ограничивает глобальные циркуляции воздуха тропосферой, принимая тем самым непосредственное участие в формировании погоды и климата на Земле. Равновесие между процессами образования и разрушения озона нарушается при изменении солнечной активности, а также при появлении в озоновом слое веществ — катализаторов разложения озона. Среди таких катализаторов важнейшая роль принадлежит оксидам азота: NO + O3 → N02 + 02 N02 + O → NO + 02, атомам хлора С1 + О3 →ClO + О ClO + О → С1 + О2, а также НО˙- радикалам HO˙+ O3 → O2 + HO2 (гидропероксидный радикал) Согласно теоретическим оценкам в результате протекания цепных каталитических реакций одна молекула N0 разрушает до 10—12 молекул 03. Однако антропогенные выбросы NO в приземном слое существенной опасности для озонового слоя не представляют, так как за время, необходимое для подъема молекул NO на высоту 25—35 км, составляющее по оценкам от 30 до 120 лет, оксид азота разрушается, вступая в химические реакции с другими веществами. Большую опасность представляет эмиссия оксида азота непосредственно в озоновом слое или в близлежащих областях из двигательных установок баллистических ракет и высотных реактивных самолетов. Несравнимо большую опасность для озона представляет атомарный хлор. Согласно расчетам, один атом хлора по цепной каталитической реакции разрушает до 105 молекул 03. В настоящее время выявлено два основных источника поступления атомарного хлора в стратосферу. Первый из них связан с непосредственной эмиссией хлора в озоновый слой при запусках твердотопливных баллистических ракет и космических аппаратов типа американского шаттла, использующих смесевые виды топлива на основе перхлоратов, например перхлората аммония NH4C104. Суммарные выбросы хлора в атмосферу при эпизодических запусках ракет и космических аппаратов невелики и оцениваются сотнями тонн в год. Гораздо более мощным источником поступления хлора в атмосферу является производство хлорфторуглеродов. В 1986 г. в мире было произведено 700 тыс. т этих веществ, а всего с начала их массового производства в 1960-х гг. — около 5 млн т. Благодаря своей высокой химической стойкости хлорфторуглероды в процессе многолетней циркуляции с воздухом поступают из приземных слоев атмосферы в озоновый слой, где подвергаются фотодиссоциации с выделением атомарного хлора. Еще большую опасность для озонового слоя по сравнению с хлорфторуглеродами представляют бромсодержащие фреоны CF2OBr и C2F2Br2, применяемые в пожаротушении. Атомы брома в несколько раз активнее разрушают озоновый слой по сравнению с хлором. При истощении озонового слоя возрастает доза облучения человека ультрафиолетовыми лучами, что ведет к росту заболеваний катарактой, кожным заболеваниям (лишай, волчанка), ослаблению иммунной системы организма. Наибольшую опасность представляет рост заболеваемости злокачественной меланомой (раком кожи) Согласно медицинским данным истощение озонового слоя на 1 % сопровождается ростом заболеваемости меланомой на 6% Увеличение ультрафиолетового солнечного излучения представляет опасность для всех живых организмов на суше и в воде. Высокие дозы этого излучения за счет действия на ДНК могут вызвать мутации у микроорганизмов, привести к ухудшению качества семян, понижению сопротивляемости растений вредителям и болезням. Установлено, что ультрафиолетовые лучи вызывают повреждение клеток и тканей у растений. По расчетам, потеря атмосферой 25% озона вызовет такой рост радиации, что количество фитопланктона в океане сократится на 35% с соответствующим уменьшением его продуктивности. Истощение озонового слоя оказывает негативное влияние и на климат Земли. Уменьшение концентрации озона ведет к снижению нагрева стратосферы с соответствующим изменением характера поведения температуры воздуха в этой области и нарушением циркулявоздушных масс в тропосфере. Данные оценки потерь озона атмосферой в Арктике весьма противоречивы. Согласно результатам спутникового наблюдения к 1981 г. истощение озонового слоя составило 1%, а за семилетний период с 1981 по 1988 г. — 4%. К 2050 г. ожидается истощение озонового слоя на 30—50%. По другим данным к 2015 г. истощение озонового слоя достигнет 17% и затем стабилизируется на этом уровне. В целях защиты озонового слоя наиболее развитые страны мира подписали в 1987 г. Монреальский протокол по сокращению производства хлорфторуглеводородов на 50%. После получения дополнительной информации о скорости разрушения озонового слоя в 1990 г. был подписан Лондонский протокол о полном запрещении производства этих веществ в 2000 г. В результате техногенного воздействия на атмосферу наблюдаются следующие негативные последствия: — превышение ПДК многих токсичных веществ (СО, N02, S02, — образование в городах фотохимического смога при интенсивных выбросах NO — выпадение кислотных дождей в регионах при интенсивных выбросах SO — проявление парникового эффекта при повышенном содержании С02, N0 — разрушение озонового слоя при поступлении NO
Воздействие на гидросферу Гидросфера — водная среда Земли, образованная совокупностью океанов, морей, поверхностных вод суши, включая лед и снег высокогорных и полярных районов. Гидросфера состоит из следующих частей (табл. 5.19).
Таблица 5.19 Состав гидросфера
Структура водопотребления (%) в Российской Федерации в 2004 г. приведена ниже: производственные нужны — 59,1; хозяйственно-питьевое потребление — 0,7; орошение — 12,6; сельскохозяйственное потребление — 1,3; прочие нужды — 6,3.
Всего из источников водопотребления в 2004 г. забрано около 80 км3 воды, а объем сточных вод составил 51,3 км3. Из них к категории загрязненных стоков отнесено 18,5 км3. Состав основных веществ, загрязняющих стоки, приведен в табл. 5.20. Таблица 5.20
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 554; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.009 с.) |

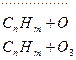 }ПАН (пероксиацилнитраты)
}ПАН (пероксиацилнитраты)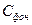 — фоновая концентрация вещества в атмосферном воздухе).
— фоновая концентрация вещества в атмосферном воздухе). , Н2S. Кислотные дожди возникают вследствие неравномерного распределения этих газов в атмосфере. Например, концентрация S02 (мкг/м3) обычно такова: в городе — 50—1000, на территории около города в радиусе около 50 км — 10—50, в радиусе около 150 км — 0,1—2, над океаном — 0,1.
, Н2S. Кислотные дожди возникают вследствие неравномерного распределения этих газов в атмосфере. Например, концентрация S02 (мкг/м3) обычно такова: в городе — 50—1000, на территории около города в радиусе около 50 км — 10—50, в радиусе около 150 км — 0,1—2, над океаном — 0,1. . Источниками соединений азота являются следующие источники:
. Источниками соединений азота являются следующие источники: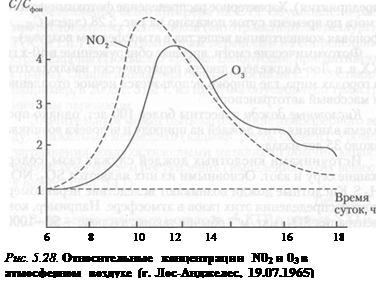
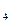
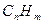 , бенз[а]пирена, свинца, бензола и др.) в городах и природных зонах;
, бенз[а]пирена, свинца, бензола и др.) в городах и природных зонах;


