
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теория возникновения электродного потенциала и ЭДССодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Значение электродного потенциала в общем случае не совпадает ни с нернстовским потенциалом, ни с разностью между нернстовскими потенциалами металла и электрода H+½H2½Pt, так как включает в себя ещё и потенциал между данным металлом и платиной. Понятие об электродном потенциале поэтому сложнее, чем понятие о скачке потенциала между электродом и раствором, и не может быть сведено к нему. Так называемая физическая теория электрохимических систем, сформулированная Вольтой ещё в начале XIX века, отводила особое место контакту между двумя разнородными металлами. По этой теории ЭДС электрохимической системы считается равной вольта-потенциалу между двумя разнородными металлами, а скачок вольта-потенциала между металлом и раствором принимается равным нулю. Возникновение тока в электрохимической системе объясняется при этом следующим образом (см. рис. 17). Если привести в непосредственное соприкосновение два различных металла, то ЭДС не возникнет, так как E = Если непосредственный контакт между двумя металлами заменить их контактом через токопроводящий раствор, то ЭДС уже будет равна не нулю, а величине E = потому что
Теория Вольты игнорирует нернстовские скачки потенциала и, таким образом, не может объяснить существования зависимости ЭДС от концентрации электролита. Помимо этого, она противоречит закону сохранения энергии, постулируя получение энергии просто из существования неизменного скачка потенциала на стыке двух металлов, то есть по существу из ничего. Физическая теория Вольты была подвергнута критике вскоре после её создания. В 1805 г. Риттер высказал взгляды, положившие начало химической теории ЭДС. Согласно этой теории, получившей наиболее полное развитие в трудах Нернста и Оствальда, источником электрической энергии являются химические реакции, протекающие на границах раздела электрод – электролит. Химическая теория верно определяет природу источника электрической энергии электрохимических систем. Она лежит в основе количественных термодинамических выражений для ЭДС и электродных потенциалов. Вместе с тем в химической теории предполагается, что ЭДС электрохимической системы слагается только из двух скачков потенциала, возникающих на тех границах раздела, где протекают токообразующие химические реакции, то есть на границах раздела электрод – электролит. При этом электродные потенциалы отождествляются со скачками потенциалов между электродом и раствором, а ЭДС – с разностью этих скачков: Е = Роли скачка потенциала на стыке двух металлов в появлении ЭДС теория не учитывает. Эти представления химической теории не отвечают действительности, и ЭДС электрохимической системы слагается из трёх скачков потенциала. Характер связи между ЭДС и отдельными скачками потенциала можно выяснить на примере электрохимической системы, состоящей из двух металлов, опущенных в растворы их токопроводящих соединений: М1ïМ1АïïМ2АïМ2ïМ1. Её ЭДС определяется уравнением E = V2,1 – VL,1 + VL,2 , так как диффузионный потенциал на границе двух растворов элиминирован. Если каким либо способом (например, подбором соответствующих составов растворов М1А и М2А) устранить скачки потенциала VL,1 и VL,2 , то ЭДС системы, вопреки представлениям химической теории, будет равна не нулю, а вольта-потенциалу металл 1 – металл 2: E = jп – jл = V2, 1. (2) Электродные потенциалы, отвечающие таким вполне реализуемым на опыте условиям, были названы А.Н.Фрумкиным потенциалами нулевого заряда. Имеются, однако, электрохимические системы, например, простая химическая цепь с газовыми электродами PtïH2 ïH2OïO2 ïPt, в которых вообще нет контакта между двумя разными металлами и, следовательно, потенциал Таким образом, в зависимости от конкретных условий ЭДС электрохимической системы определяется либо гальвани-потенциалом между двумя разнородными металлами, либо гальвани-потенциалами на стыке металлов и раствора, либо всеми тремя скачками потенциала. Иными словами, в одних случаях реализуется механизм образования ЭДС, постулированный физической теорией, в других – химической, в третьих – все скачки потенциала вносят свой вклад в величину ЭДС, то есть в какой-то мере каждая из двух теорий отражает истинные соотношения. В этом состоит одно из решений так называемой проблемы Вольты, данное А.Н.Фрумкиным и основанное на концепции потенциалов нулевого заряда.
|
||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 531; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.249.76 (0.008 с.) |

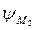 –
– 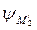 =
= 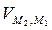 +
+ 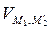 =
= 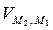 = 0.
= 0.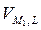 +
+ 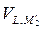 =
= 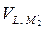 = 0. В результате через систему потечёт электрический ток, то есть она будет генерировать электрическую энергию.
= 0. В результате через систему потечёт электрический ток, то есть она будет генерировать электрическую энергию.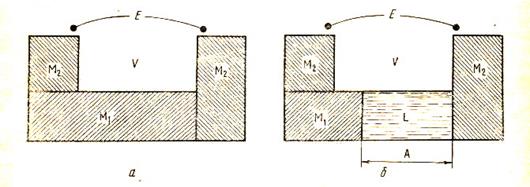
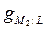 –
– 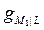 . (1)
. (1)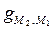 не участвует в создании ЭДС. В подобных случаях ЭДС системы определяется уравнением (1), которое является прямым следствием химической теории. Наличие потенциала между двумя разными металлами нельзя считать, таким образом, обязательным условием появления ЭДС и получения энергии от электрохимической системы. Электрическую энергию можно получать, вопреки представлениям физической теории, от электрохимической системы, в которой оба электрода сделаны из одного и того же металла.
не участвует в создании ЭДС. В подобных случаях ЭДС системы определяется уравнением (1), которое является прямым следствием химической теории. Наличие потенциала между двумя разными металлами нельзя считать, таким образом, обязательным условием появления ЭДС и получения энергии от электрохимической системы. Электрическую энергию можно получать, вопреки представлениям физической теории, от электрохимической системы, в которой оба электрода сделаны из одного и того же металла.


