
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация электрохимических цепей. Физические цепи. Концентрационные цепи. Химические цепи. АккумуляторыСодержание книги
Поиск на нашем сайте Учитывая природу электродной реакции, можно классифицировать не только различные типы электродов, но и их комбинации. Электрохимические цепи обычно классифицируют по двум признакам: по источнику электрической энергии (физические, концентрационные, химические) и по наличию или отсутствию в цепи границы двух различных растворов (цепи с переносом и без переноса). 1. Система составлена из двух химически одинаковых электродов, на которых совершается одна и та же электродная реакция. ЭДС таких систем была бы равна нулю, если бы физические свойства электродов, а следовательно, и их стандартные потенциалы были одинаковыми. Электрохимические системы, в которых электроды отличаются только физическими свойствами, называются физическими цепями. Как правило, один из двух электродов физической цепи находится в более устойчивом, а другой - в менее устойчивом при данных условиях состоянии. Источником электрической энергии в физических цепях служит свободная энергия перехода электрода из менее устойчивого в более устойчивое состояние. 2. Два электрода совпадают по своим физическим свойствам, качественному химическому составу и природе электродной реакции. Они отличаются лишь тем, что активность одного или нескольких участников реакции на электродах неодинакова. Электрохимические цепи, в которых электроды отличаются только активностью (концентрацией) участников электродной реакции, называются концентрационными цепями. Источником электрической энергии в концентрационных цепях служит энергия переноса вещества от большей активности к меньшей. 3. Два электрода могут отличаться и по химическим, и по физическим свойствам. Такие цепи называются химическими. В химических цепях источником электрической энергии служат протекающие в них химические реакции. Физические цепи Гравитационные цепи. Такие цепи состоят обычно из двух жидких электродов разной высоты, изготовленных из одного и того же металла. Электроды погружены в раствор соли данного металла. Подобную цепь с ртутными электродами высотой h1 и h2 (h1 > h2), опущенными в раствор соли ртути HgA, можно представить следующей схемой: Hg êHgA êHg. (h1) > (h2) Электрод большей высоты (h1) обладает повышенным запасом свободной энергии по сравнению с электродом менее высоким, поэтому он растворяется с образованием ионов ртути: Hg (h1) ® 1/2 Hg22+ + e, тогда как на правом электроде, с меньшим запасом энергии, ионы ртути разряжаются и выделяется металлическая ртуть: 1/2 Hg22+ + e ® Hg (h2). Суммарный процесс в гравитационной цепи состоит, следовательно, в переносе ртути от высокого электрода к низкому: Hg (h1) ® Hg (h2). Этот самопроизвольный процесс продолжается до тех пор, пока высоты электродов не сравняются. Таким образом, гравитационные цепи представляют собой электрохимические системы, в которых механическая энергия, обусловленная разницей электродов по силе тяжести, превращается в электрическую энергию благодаря протекающим в них электрохимическим реакциям. ЭДС гравитационных цепей зависит от разности высот; она обычно очень мала: составляет, например, для ртути при Dh = 1м всего около 2×10–5 В. Такие цепи не имеют практического значения, но они интересны тем, что говорят о возможности генерирования электрической энергии в системах с химически одинаковыми электродами. Аллотропические цепи. Электродами служат две модификации одного и того же металла (Мa и Мb), погруженного в раствор или расплав его ионопроводящего соединения. При данной Т только одна из модификаций устойчива (если это не Т фазового превращения, при которой существуют в равновесии обе модификации), другая находится в метастабильном состоянии. Электрод, изготовленный из металла в метастабильном состоянии (пусть это будет Мb), обладает повышенным запасом свободной энергии. Он играет роль отрицательного электрода элемента и посылает ионы металла в раствор: Мb = М n + + ne. На электроде, изготовленном из устойчивой a-модификации, происходит разряд металлических ионов М n + + ne = Мa. Таким образом, общая реакция в аллотропической цепи Мb êМА êМa заключается в переносе металла от метастабильной модификации к устойчивой: Мb ® Мa, то есть в электрохимическом превращении неустойчивой модификации в устойчивую. Возникающие разности потенциалов обычно малы, но в некоторых процессах (в частности, в процессах коррозии) их необходимо принимать во внимание. Физические цепи являются цепями без переноса. Концентрационные цепи Концентрационные цепи первого рода. К концентрационным цепям первого рода относят системы, состоящие из двух электродов, одинаковых по своей природе, но отличающихся по количественному составу; оба электрода погружены в один и тот же раствор. Концентрационные цепи первого рода – цепи без переноса, так как содержат всего один раствор. Типичным примером концентрационных цепей являются амальгамные цепи, в которых отличие между электродами сводится лишь к неодинаковой активности металла, растворенного в амальгаме: Hg, M êMA êM, Hg. (a I) > (a II) Если a I > a II, то на левом электроде металл растворяется и переходит в раствор в виде ионов MHg (a I) = M n + + ne + Hg, а на правом электроде совершается та же реакция, но в обратном направлении: M n + + ne + Hg = MHg (a II). Суммарный процесс сводится к переносу металла от концентрированной амальгамы к разбавленной: MHg (a I) ® MHg (a II). ЭДС такой системы равна Е = Перенос происходит до тех пор, пока сохраняется различие в концентрациях (активностях) амальгам, использованных в качестве электродов. Примером амальгамной цепи служит элемент, изготовленный из амальгам калия разной активности и раствора хлорида калия: Hg, K êKCl êK, Hg. (a I) > (a II) Другим примером концентрационных цепей первого рода служат простые газовые цепи, составленные из двух одинаковых газовых электродов, отличающихся лишь давлением газа. ЭДС таких систем можно найти из механической работы, совершаемой при переходе 1 моля газа от высокого давления р ¢ к низкому р ¢¢: Е = Например, ЭДС водородной газовой цепи Pt êH2 êHCl êH2 êPt ( определяется уравнением Е = На левом электроде будет наблюдаться ионизация водородного газа, а на правом - разряд водородных ионов и переход водорода в газовую фазу. Из уравнения для ЭДС следует, что для газов типа водорода и хлора с n = 2 ЭДС газовой цепи при отношении р ¢/ р ¢¢ = 10 и при 25оС составит около 0,030 В. Для кислородной газовой цепи (n = 4) при тех же условиях ЭДС равна 0,015 В. Концентрационные цепи второго рода. Эти цепи включают в себя два одинаковых электрода, погруженных в растворы одного и того же электролита различной активности. В зависимости от того, по отношению к каким ионам электролита обратимы электроды, концентрационные цепи второго рода разделяются на катионные, например I II Hg, K êKCl¦KCl êK, Hg, (a I) < (a II) и на анионные, например Ag êAgCl êHCl¦HCl êAgCl êAg. (a I) > (a II) Процесс, вызывающий появление ЭДС в цепях такого рода, заключается в переносе электролита из концентрированного раствора в разбавленный; концентрационные цепи второго рода относятся к цепям с переносом. Существование между растворами границы, через которую совершается перенос ионов и где локализуется диффузионный потенциал, позволяет определять их также как цепи с жидкостной границей. Рассмотрим процесс образования ЭДС в концентрационных цепях второго рода на примере анионной цепи. Пусть a I > a II, тогда у левого электрода будет протекать реакция Ag + Cl–I = AgCl + e и совершаться перенос ионов в соответствии с их числами переноса - t + H+I + t - Cl–I. У правого электрода будут протекать те же процессы, но в обратном направлении: во-первых, превращение хлорида серебра в металлическое серебро и ионы хлора AgCl + e = Ag + Cl–II и, во-вторых, перенос ионов t+ H+II - t - Cl–II. Сумма всех электродных процессов дает общее уравнение электрохимической реакции в анионной цепи: Ag + AgCl + t + H+I + (1 – t -) Cl–I = Ag + AgCl + t+ H+II + (1 - t -) Cl–II, t + H+I + t + Cl–I = t + H+II + t + Cl–II. Таким образом, источником электрической энергии в данной концентрационной цепи является перенос t + молей HCl от более концентрированного раствора к менее концентрированному. Выражение для ЭДС анионной концентрационной цепи второго рода имеет вид Е = Ео + поскольку Ео = Eо1 + Eо2 = 0 для системы с двумя одинаковыми электродами, включенными навстречу друг другу. Свяжем активность отдельных ионов электролита с его средней активностью: а + а - = а ±2, тогда Е = 2 t + 2,303 Аналогично выводится уравнение для ЭДС катионной концентрационной цепи второго рода. Так, для вышеприведенной амальгамной цепи Е = – 2 t – 2,303 Из уравнений следует, что, измерив ЭДС цепи с переносом при различных концентрациях электролита, можно найти числа переноса образующих его ионов. Вышеприведенные выражения для ЭДС концентрационной цепи второго рода включают величину диффузионного потенциала на границе двух растворов одного и того же электролита различной концентрации. Для вычисления диффузионного потенциала в этом случае следует иcпользовать уравнение
при этом для анионной концентрационой цепи a I > a II, а для катионной цепи a I < a II. Химические цепи Химические цепи принято разделять на простые и сложные. В простых химических цепях один из электродов обратим по отношению к катионам электролита, а другой - к его анионам. В сложных химических цепях это условие не соблюдается. Простые химические цепи. В водородно-кислородном элементе М1 êН2 êН2О êО2 êМ2 источником электрической энергии служит химическая энергия реакции между кислородом и водородом с образованием воды Н2 + 1/2 О2 = Н2О. Выражение для ЭДС водородно-кислородного элемента имеет вид Е = Ео + К этому же уравнению можно прийти, рассмотрев частные электродные реакции. На водородном электроде протекает реакция ионизации водорода Н2 = 2Н+ + 2 е, а на кислородном - реакция ионизации кислорода с образованием гидроксильных ионов 1/2 О2 + Н2О + 2 е = 2ОН–. Сумма электродных реакций дает общую реакцию в химической цепи Н2 + 1/2 О2 + Н2О = 2Н+ + 2ОН–; Е = Ео¢ + Преобразуем выражение, положив Е = Ео¢ - Полученное выражение совпадает с вышеприведенным выражением для ЭДС при Ео = Ео¢ - При 25оС Ео = = 0 + 0,401 - 0,059 lg 10-14 = 0,401 + 0,829 = 1,230 В; Е = 1,230 + 0,03 lg Видно, что ЭДС водородно-кислородного элемента зависит от парциальных давлений водорода и кислорода, увеличиваясь с их ростом по логарифмическому закону. Она не зависит от рН среды и должна быть одной и той же в чистой воде и в растворах щелочи или кислоты. Так как электропроводность чистой воды очень низка, то на практике применяют растворы щелочи, чаще всего раствор КОН: М1 êН2 êКОН êО2 êМ2. Другим примером простых химических цепей может служить стандартный элемент Вестона Pt êHg, Cd êCdSO4 êHg2SO4 êHg êPt, ЭДС которого отличается очень большим постоянством во времени и малым температурным коэффициентом. В элементе Вестона левый электрод обратим по отношению к ионам кадмия Cd = Cd2+ + 2 e, а правый - по отношению к сульфат-ионам Hg2SO4 + 2 e = 2Hg + SO42–. Общая реакция, протекающая в элементе: Cd + Hg2SO4 = Cd2+ + SO42– + 2Hg. При учете постоянства активностей твердых веществ ЭДС элемента Вестона описывается уравнением Е = Ео - Следовательно, его ЭДС определяется активностью раствора сульфата кадмия. В электрохимической практике для измерения ЭДС компенсационным методом чаще всего применяют элементы Вестона с насыщенным раствором CdSO4. Амальгамный электрод в таком элементе содержит 12,5% кадмия. ЭДС насыщенного элемента Вестона при Т, близкой к комнатной, находят по уравнению E t = 1,0183 - 4,0×10–5 (t - 20). Третьим примером простых химических цепей может служить свинцовый, или кислотный, аккумулятор (см. ниже, «Аккумуляторы»). Простые химические цепи – цепи без переноса. Однако подавляющее большинство химических цепей – это цепи с переносом, в которых растворы соединены или непосредственно, или через солевой мостик. Комбинируя различные окислительно-восстановительные полуреакции, можно построить очень большое число химических цепей. Разность соответствующих стандартных потенциалов позволяет в первом приближении оценить ЭДС этих цепей. Точное значение ЭДС химических цепей с переносом рассчитать не удается, во-первых, из-за невозможности точного определения диффузионного потенциала, и во-вторых, из-за неизбежной замены активностей отдельных ионов в формуле Нернста средними активностями или просто концентрациями этих ионов. Сложные химические цепи. Примером сложных химических цепей является элемент Даниэля – Якоби Zn êZnSO4¦CuSO4 êCu, в котором протекает реакция Zn + Cu2+ = Zn2+ + Cu. Левый электрод - отрицательный полюс элемента - обратим по отношению к ионам цинка, а правый - положительный полюс элемента - по отношению к ионам меди. ЭДС элемента Даниэля – Якоби зависит поэтому от отношения активностей ионов меди и цинка: Е = Ео + В этом элементе имеется граница между двумя растворами, на которой возникает диффузионный потенциал, поэтому ЭДС элемента в действительности сложнее. Однако, поскольку подвижности ионов меди и цинка не слишком отличаются друг от друга и концентрации сульфата меди и цинка близки между собой, диффузионный потенциал не играет существенной роли в создании ЭДС этого элемента. Сдвоенные химические цепи. В сдвоенных химических цепях две простые химические цепи, отличающиеся лишь активностью электролита, имеют один общий электрод и, таким образом, электрически соединены через проводник первого рода в единую цепь. Например, простые цепи с хлоридсеребряным и водородным электродами можно превратить в сдвоенную цепь с общим водородным электродом: I II Ag êAgCl êHCl êH2 êPt êH2 êHCl êAgCl êAg. (a I) > (a II) В каждой из двух ячеек цепи протекает одна и та же реакция Ag + H+ + Cl– = AgCl + 1/2 H2, но в противоположных направлениях, причем если a I > a II, то в первой ячейке реакция идет слева направо, а во второй - справа налево: Ag + H+I + Cl–I = AgCl + 1/2 H2; AgCl + 1/2 H2 = Ag + H+II + Cl–II. Суммарный процесс эквивалентен переносу 1 моль ионов водорода и 1 моль ионов хлора из первой ячейки во вторую H+I + Cl–I = H+II + Cl–II , хотя фактический перенос в этой системе из-за отсутствия непосредственной границы раздела между растворами исключен и изменение содержания HCl обусловлено не переносом ионов, а химическими реакциями, протекающими в цепи. Сдвоенные химические цепи являются поэтому цепями без переносаили цепями без жидкостной границы. На основании уравнения реакции ЭДС системы будет равна Е = Ео + причем стандартная ЭДС Ео равна 0, так как в обеих ячейках протекает одна и та же реакция, но в противоположных направлениях. При этом на одной стороне водородного электрода (общего для обеих ячеек) совершается катодный процесс Н+ + е = 1/2 Н2, а на другой - анодный 1/2 Н2 = Н+ + е. Подобные электроды называются биполярными и широко используются электрохимической промышленностью. И по характеру процесса, и по форме уравнения для ЭДС двойная химическая цепь напоминает концентрационные цепи второго рода. Однако в сдвоенных химических цепях нет диффузионного потенциала и связанных с ним осложнений. Сопоставление ЭДС сдвоенной химической цепи и ЭДС концентрационной цепи с переносом с тем же электролитом позволяет определить его числа переноса. Сопоставление ЭДС двойной химической цепи с ЭДС соответствующей его простой цепи дает возможность с большой точностью находить стандартные потенциалы их электродов и коэффициенты активности электролитов. Аккумуляторы Любая электрохимическая цепь в принципе может служить источником электрического тока. По разным причинам (малая электрическая емкость, малая скорость и необратимость химических реакций, физические изменения электродов при эксплуатации и т.д.) большая часть цепей не может быть практически использована для получения электрического тока, и лишь немногие имеют прикладное значение в качестве химических источников тока. Химические источники тока делятся на источники тока одноразового действия (гальванические элементы) и многоразового действия (аккумуляторы). В аккумуляторах при пропускании через них тока от внешней цепи (заряжение) происходят химические изменения в электродах и растворах, близких к обратимым, и работа электрического тока аккумулируется (запасается) в форме свободной энергии продуктов реакции. Заряженный аккумулятор дает ток при разряжении, после чего вновь может быть заряжен. Наиболее широко используют кислотный свинцовый, щелочной кадмиево-никелевый и щелочной серебряно-цинковый аккумуляторы. Свинцовый аккумулятор в заряженном состоянии представляет собой элемент (-) Pb êPbSO4 êH2SO4 (32-34 %) êPbO2 êPb (+). Здесь имеется два электрода второго рода: свинцово-сульфатный, обратимый по отношению к сульфат-ионам, и свинцово-диоксидный, обратимый по отношению к гидроксильным ионам, а следовательно, и к ионам водорода (как всякий металлоксидный электрод). При работе аккумулятора протекают следующие электродные реакции: на левом электроде (свинцово-сульфатном) Pb + SO42– на правом электроде (свинцово-диоксидном) PbO2 (т) + 4H+ + SO42– + 2 e Суммарная реакция в цепи Pb + PbO2 (т) + 4H+ + 2SO42–
откуда ЭДС цепи равна Е = Ео + (поскольку При 25оС Е = 2,04 + 0,059 lg В свинцовых аккумуляторах применяются концентрированные растворы серной кислоты, поэтому активность воды здесь не будет постоянной и ее нельзя включать в величину Ео . Токообразующие процессы отвечают теории двойной сульфатации Гладстона и Трайба. По этой теории оба электрода при разряде переходят в сульфат свинца. Когда они становятся одинаковыми по своему химическому составу, то есть превращаются в электроды второго рода SO42– êPbSO4 êPb, ЭДС цепи падает до нуля. Продукт электродных реакций - твердый сульфат свинца - обладает способностью удерживаться на поверхности электродов. Поэтому при прохождении тока в обратном направлении (при подключении внешнего источника тока) реакции идут справа налево, в сторону регенерации исходных веществ - металлического свинца и диоксида свинца. После регенерации электрохимическая цепь снова может стать источником электрической энергии. Такие циклы разряда и заряда могут повторяться много раз, и после каждого нового заряда восстанавливается исходное состояние системы. Рассмотренная цепь была первым аккумулятором; идея его создания была высказана Якоби и осуществлена в 1859 г. Планте. В ХХ веке были предложены щелочные аккумуляторы: железо-никелевый (Эдиссон), кадмий-никелевый (Юнгер) и цинк-серебряный (Андре). Кадмиево-никелевый аккумулятор в заряженном состоянии представляет собой электрохимический элемент (-) Cd êCd(OH)2ï KOH (20%) ï Ni(OH)2 , Ni(OH)3 êNi (+). Суммарная реакция в этом элементе Cd + 2Ni(OH)3
Значение DG для этой реакции не должно зависеть от концентрации щелочи, так как в суммарной реакции участвуют только твердые вещества. Однако реакции на электродах сопровождаются изменением концентрации щелочи и образованием разности концентраций у двух электродов: Cd + 2OH– 2Ni(OH)3 + 2 e Тем не менее, в результате естественного перемешивания в условиях близости электродов эта разность концентраций практически не возникает. ЭДС кадмиево-никелевого аккумулятора равна приблизительно 1,36 В. Железо-никелевый аккумулятор. В этом щелочном аккумуляторе кадмий и гидроксид кадмия заменены железом и оксидом железа (II). Серебряно-цинковый аккумулятор. Анодом является пористая цинковая пластинка, катодом - окислы серебра Ag2O и AgO. Электролит - концентрированный раствор КОН, насыщенный цинкатом калия Zn(OK)2. Заряженный аккумулятор может быть представлен в виде (-) Zn êZn(OK)2 , KOH (40%) êAgO или Ag2O êAg (+). Суммарная реакция в этом элементе AgO + Zn Процесс идет в две стадии: AgO восстанавливается сначала до Ag2O, затем - до металлического серебра. ЭДС элементов с катодом AgO равна 1,86 В, с катодом Ag2O - 1,58 – 1,60 В (при 25оС). После разряда аккумулятора имеем (-) Zn êZnO êZn(OK)2 , KOH (40%) êAg (+). В этих аккумуляторах в отличие от свинцовых и щелочных электролит в реакциях заряда и разряда не участвует, поэтому его можно брать очень мало. Это позволило создать аккумуляторы, имеющие очень эффективную конструкцию: электроды помещены вплотную друг к другу и разделены только тонким слоем целлофана. Весь электролит находится в порах электродов. Серебряно-цинковые аккумуляторы имеют большую емкость, высокую энергию и высокую мощность на единицу массы и объема. Они широко применяются там, где необходимы аккумуляторы небольшого размера. В заключение этого раздела приведем общий подход, использование которого позволяет избежать рассмотрения гальвани-потенциалов при сопоставлении ЭДС цепей. Этот подход включает следующие положения (правила). 1. ЭДС цепи – это потенциал правого электрода относительно левого. 2. Предполагается, что на правом электроде происходит восстановление (присоединение электрона к участвующему в электродном процессе компоненту), а на левом – окисление (анодный процесс с переходом электрона на металл). Если же в реальной системе происходят обратные процессы, то найденная величина Е окажется отрицательной. 3. Предполагается, что на границе двух растворов в цепях с переносом катионы в количестве t + n+ переходят слева направо, а анионы в количестве t – n– – справа налево. При противоположном направлении переноса величина Е окажется отрицательной. 4. Сложение всех процессов с учетом условия равенства чисел электронов, возникающих на левом электроде и расходуемых на правом, получают суммарную химическую реакцию, для которой DG = 5. ЭДС цепи определяют по формуле Е = – DG/ n F. При этом, если реакция идет самопроизвольно, то DG < 0 и Е > 0. В противном случае DG > 0 и Е < 0. Лекция 10
|
||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 1077; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.015 с.) |

 ln
ln 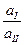 .
. .
. ) > (
) > ( )
) ln
ln  .
. ln
ln  = t +
= t +  ,
, .
. .
. ,
, .
. .
. = 1 и учтя, что
= 1 и учтя, что  = Kw:
= Kw: +
+  -
-  = Ео -
= Ео -  .
. .
. ,
, PbSO4 (т) + 2 е;
PbSO4 (т) + 2 е;
 = Ео +
= Ео +  = Ео +
= Ео + 
 - общей активности серной кислоты).
- общей активности серной кислоты). .
. , где индексы i и j обозначают незаряженные исходные вещества и продукты реакции, соответственно.
, где индексы i и j обозначают незаряженные исходные вещества и продукты реакции, соответственно.


