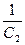Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дальнейшее развитие теории строения ДЭССодержание книги
Поиск на нашем сайте
Современные теоретические представления о ДЭС базируются на основной модели Штерна, но содержат ряд усовершенствований, которые были внесены в теорию в последующие годы. В теории Штерна не учитывалось различие минимального расстояния, до которого могут приближаться к поверхности электрода электрические центры поверхностно-неактивных и специфически адсорбирующихся ионов. В действительности, ионы, которые специфически адсорбированы, частично дегидратированы со стороны металла, а потому они входят внутрь плотного слоя, и их электрические центры располагаются ближе к поверхности электрода, чем такие же центры полностью гидратированных поверхностно-неактивных ионов. В результате вместо одной плоскости Гельмгольца необходимо было ввести две плоскости: внутреннюю и внешнюю. На внутренней плоскости Гельмгольца локализуются центры специфически адсорбированных ионов, а внешняя плоскость Гельмгольца представляет собой границу максимального приближения к поверхности электрических центров всех ионов, находящихся в диффузной части ДЭС и участвующих в тепловом движении. Было предпринято много попыток разработать теорию ДЭС, количественно согласующуюся с опытными данными (Райс, Фрумкин с сотр., Бокрис, Деванатхан, Есин, Мюллер, Парсонс, Эршлер и др.). Наибольшее признание получила модель Грэма (1947). Согласно Грэму, обкладка ДЭС, находящаяся в растворе, состоит не из двух, а из трех частей. Первая, считая от поверхности металла, называется внутренней плоскостью Гельмгольца; в ней находятся лишь поверхностно-активные ионы (заряд плоскости равен q1) либо, если их нет в растворе, молекулы растворителя (q1 = 0); потенциал ее, отнесенный к раствору, обозначается y1 . Следующая, удаленная от поверхности металла на расстояние, до которого могут подходить ионы (центры их заряда), называется внешней плоскостью Гельмгольца; ее общий заряд равен q2 , а потенциал плоскости y2 . За внешней плоскостью Гельмгольца располагается диффузный слой с потенциалом, изменяющимся от y2 до нуля и с плотностью заряда, совпадающей с q2 . На рис. 25 дано схематическое изображение строения ДЭС по Грэму для незаряженной поверхности, заряженной положительно и отрицательно. В соответствии с допущением Грэма о том, что следует считаться лишь с поверхностной активностью анионов (в системах, не содержащих органических растворенных веществ), в первой плоскости Гельмгольца находятся только специфически адсорбирующиеся анионы, причем их поверхностная концентрация растет при переходе от незаряженной поверхности к заряженной положительно. При достаточно отрицательном заряде поверхности во внутреннем слое Гельмгольца остается лишь растворитель, и заряд его, так же как и в растворе, не содержащем ПАВ, делается равным нулю (q1 = 0). В этих условиях qM = – qL = – q2 и ДЭС электрически эквивалентен двум последовательно включенным конденсаторам, то есть оправдывается формула, применимая и к модели Штерна:
(С1 – емкость плотной части ДЭС, С2 – емкость диффузной части ДЭС).
Грэм предполагал, что емкость конденсированной части ДЭС зависит от заряда металла, но не от концентрации раствора. Это предположение позволило Грэму предложить метод расчета кривых дифференциальной емкости для любых концентраций данного электролита, если имеется экспериментальная кривая хотя бы для одного его раствора. Проверка, проведенная Грэмом, показала хорошую сходимость рассчитанных кривых емкость – потенциал и кривых, полученных экспериментально. Модель Грэма отражает основные черты и особенности структуры ДЭС металл – электролит. Однако и эта модель охватывает далеко не все аспекты проблемы: 1. Вряд ли допустимо рассматривать ионы, находящиеся во внутренней обкладке ДЭС, как равномерно размазанные по поверхности металла; надо учитывать дискретность зарядов. 2. В подавляющем большинстве случаев поверхность электрода поликристаллична и представляет собой набор участков, отвечающих граням разного индекса. Разные грани одного и того же металла обладают неодинаковыми работами выхода электрона и нулевыми точками; различия могут достигать нескольких десятых вольта. В итоге заряды граней оказываются не только неодинаковыми по значению, но могут оказаться и обратными по знаку. Таким образом, кристаллическая микронеоднородность может приводить к радикальным изменениям в структуре ДЭС. 3. Нерешенным остается вопрос, связанный с участием и вкладом электронов в структуру ДЭС. Кроме разности потенциалов, создаваемой зарядами металла и ионами двойного слоя, электрические свойства границы раздела электрод/раствор зависят также от находящихся на поверхности диполей растворителя; ориентация диполей изменяется при изменении заряда электрода. Модели ДЭС, учитывающие изменение ориентации диполей растворителя, разрабатывались с начала 1960-х годов. В первых моделях предполагалось существование в плотной части ДЭС двух состояний диполей воды, ориентированных либо положительным, либо отрицательным концом к поверхности электрода. Эти диполи взаимодействовали с зарядами электрода и друг с другом по законам классической электростатики; при изменении заряда электрода изменялось долевое отношение диполей с противоположными ориентациями. В дальнейшем модели этого типа уточнялись с учетом значительного числа эффектов: возможного образования ассоциатов из двух или более молекул растворителя; наличия диполей, ориентированных параллельно или наклонно к поверхности; существования неэлектростатических взаимодействий между молекулами растворителя как в пределах ближайшего к поверхности монослоя, так и в соседних слоях. Существенную роль в строении ДЭС на границе электрод/раствор играет выход электронного газа за пределы кристаллической решетки металла (ионного остова). Поверхностный потенциал металла c М(L) , измененный контактом с растворителем, также зависит от заряда электрода, что должно отразиться как на емкости ДЭС, так и на пограничном натяжении электрода. Вклад «металлической» составляющей в емкость ДЭС был впервые рассмотрен О.Райсом еще в 1928 г. Но эта работа значительно опередила свое время, и к обсуждению роли электронов металла в структуре и свойствах границы раздела электрод/раствор ученые всерьез приступили лишь после 1982 г. Наконец, на строение границы электрод/раствор существенное влияние оказывает адсорбция нейтральных органических молекул. В этом случае раздвигаются обкладки двойнослойного конденсатора, снижается диэлектрическая постоянная плотного слоя, а также возникает дополнительный скачок потенциала, связанный с ориентированной адсорбцией органических диполей. Первая модель, описывающая обратимую адсорбцию на границе ртуть/вода простых алифатических соединений, была предложена А.Н.Фрумкиным еще в 1928 г. В основу этой модели, получившей название модели двух параллельных конденсаторов, были положены два уравнения, связывающие степень заполнения поверхности органическим веществом с его объемной концентрацией (изотерма адсорбции) и с зарядом электрода. Введение некоторых уточнений в эту модель позволило в дальнейшем с ее помощью описать весьма сложную форму кривых дифференциальной емкости на границе ряда металлов (Hg, Bi, Pb, Sn, Cd, Tl, Ga) с водными растворами многих органических веществ. В последние годы были предприняты усилия по разработке статистических теорий обратимой адсорбции органических молекул на поверхности электрода.
|
|||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 370; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.186.132 (0.01 с.) |

 =
=  +
+